Energia livre e energia de activação
Reacção enzima-substracto
Apoenzimas e coenzimas
Conformação dos enzimas
Cinetica enzimatica
Activadores e inibidores
Especificidade dos enzimas
Classificação dos enzimas
Directorios
Textos
Capitulo 1
ENERGIA LIVRE E ENERGIA DE ACTIVAÇÃO
Textos
Conceito de enzima
Energia livre
Conceito
Suponhamos a reacção:
A + B --------------- C + D
P1 P2
A reacção indicada no sentido da seta só será possível se P1 for maior que P2
- A variação de energia F ( energia livre) será:
F = P1-P2
Reacções exergonicas e endergonicas
Quando uma reacção corresponde a uma diminuição da energia livre (reacção exergonica) , a sua realização é espontânea
Quando corresponde a um aumento (reacção endergonica) necessitam de um fornecimento exterior de energia
Os processos endergonicos estão acoplados a processos exergonicos
Estas transferências fazem-se sem empregar calor o que representa uma grande economia do organismo, pois o calor é a forma mais degradada de energia
Animações:
Energia de activação
Para que uma reacção se produza é preciso que haja choques entre moléculas e que estes choques sejam eficazes
Estes choques só serão eficazes se as moléculas que os sofrerem estiverem num estado reaccional particular, o estado activado
A energia da colisão deverá ser maior que a energia de ligação que une os atomos
A passagem do estado normal ao activado necessita de uma certa quantidade de energia, a energia de activação
cortesia de Micael Gregory
Podemos definir energia de activação como a quantidade mínima de energia para produzir uma reacção quimica
O seu valor poderá ser consideravelmente reduzido na presença de enzimas
cortesia de Micael Gregory
Animações
Capitulo 2
REACÇÃO ENZIMA-SUBSTRACTO
Conceito
A maior parte das reacções quimicas não se realizam espontaneamente – são aceleradas por catalise
Catalise é a aceleração de numa reacção química por uma substancia que no fim da reacção surge inalterada e na mesma concentração
Os catalisadores das reacções bioquimicas são os enzimas
Características
São proteínas com pesos moleculares de 10.000 a 2.000.000
Não causam as reacções, mas aceleram a sua actividade
Não são consumidos nem produzidos no de decorrer da reacção
São específicos
Fases da acção enzimática
A acção enzimática pode dividir-se em três fases :
- Estado inicial
- Estado activo
- Estado final
Estado inicial
As moléculas que reagem chegam a uma zona privilegiada da superficie do enzima, o
centro activo
Estado activo
As moléculas são fixadas nesta zona, criando-se as condições óptimas para reagirem
Estado final
Libertação do produto final
Reacção enzima-substracto
Sítios
Para realizar a sua acção, o enzima tem bolsas ou reentrâncias na sua superfície
Sitio catalítico ou centro activo
É onde se realizam as reacções
Sitio de ligação
Mantem o substracto na sua posição correcta
O substracto mantem-se por ligações fracas não covalentes
Animações
Etapes de uma reacção enzimática
- Complexo enzima-substracto(ES) – devido a fixação do substracto no centro activo
- Complexo enzima-produtos de reacção(EF - Formação dos produtos de reacção
Por vezes alguns aminoácidos do enzima tem funções especificas de ligação, orientação e activação
Características de uma reacção enzimática
- Os enzimas nunca tornam realizável uma reacção termodinamicamente impossível
- Os enzimas aumentam a velocidade da reacção
- Os enzimas encontram-se intactos no fim da reacção
- Quando a reacção é reversível os enzimas aceleram do mesmo modo as duas reacções, respeitando as leis da termodinamica
Animações
Capitulo 3
Apoenzimas e coenzimas
Textos
Apoenzimas
A maior parte dos enzimas são heteroproteinas
A sua parte proteica designa-se por apoenzima e não proteica como coenzima
Ao conjunto apoenzima-coenzima denomina-se holoenzima
Coenzimas
Tipos de coenzimas
- Grupos prosteticos ligados fortemente aos coenzimas
- Cosubstractos ou coenzimas propriamente ditos, ligados fracamente ao apoenzima
coenzymes in group transfer reactions
|
coenzyme
|
abbreviation
|
entity transfered
|
nicotine adenine dinucelotide
|
electron (hydrogen atom)
| |
nicotine adenine dinucelotide phosphate
|
NADP -Partly composed of niacin
|
electron (hydrogen atom)
|
flavine adenine dinucelotide
|
electron (hydrogen atom)
| |
coenzyme A
|
CoA
|
Acyl groups
|
coenzymeQ
|
electrons (hydrogen atom)
| |
thiamine pyrophosphate
|
thiamine (vit. B1)
|
aldehydes
|
pyridoxal phosphate
|
pyridoxine (vit B6)
|
amino groups
|
biotin
|
Biotin
|
carbon dioxide
|
carbamide coenzymes
|
vit. B12
|
alkyl groups
|
Cofactor
|
enzyme or protein
|
Zn++
|
carbonic anhydrase
|
Zn++
|
alcohol dehydrogenase
|
Fe+++ or Fe++
|
cytochromes, hemoglobin
|
Fe+++ or Fe++
|
ferredoxin
|
Cu++ or Cu+
|
cytochrome oxidase
|
K+ and Mg++
|
pyruvate phosphokinase
|
Propriedades dos coenzimas
Não são de natureza proteica
Têm um peso molecular pouco elevado
Entram na reacção catalisada pelo enzima – reagem molécula a molécula com o substracto
São termoestaveis ao contrario dos apoenzimas que são termolabeis
Não são responsáveis pela especificidade – o apoenzima escolhe o substracto, o coenzima intervem na reacção
No fim da reacção encontram-se inalterados
A maior parte não é sintetizada pelo organismo – são vitaminas
Propriedades dos grupos prosteticos
Estão solidamente ligados ao apoenzima por ligações covalentes
Entra na reacção sem se libertar do apoenzima – trabalha sempre ligado ao mesmo apoenzima
Propriedades dos cosubstractos
Estão fracamente ligados ao apoenzima
No estado final o cosubstracto encontrar-.se ligado a outro apoenzima – no decorrer da reacção separou-se e foi regenerado por outro apoenzima
Capitulo 4
CONFORMAÇÃO DOS ENZIMAS
Sitio activo
Textos
Nem todos os aminoácidos do apoenzima têm a mesma importancia na actividade enzimática
A parte da estrutura do apoenzima que entra em contacto com o substracto chama-se sitio activo
Classificação dos aminoácidos do apoenzima
Distinguem-se por importância funcional crescente
Aminoácidos não colaboradores
O seu papel é desconhecido. Podem ser removidos sem diminuir a actividade do enzima
Aminoácidos colaboradores
Servem de suporte aos aminoacidos funcionais. Se forem removidos, a actividade enzimática mantem-se mas o enzima torna-se muito frágil
Aminoácidos auxiliares
Asseguram a mobilidade das zonas próximas do centro activo. Asseguram a flexibilidade da molécula
Aminoacidos de contacto
São os componentes do sitio activo
Combinação do enzima com o substracto
Para que o substracto esteja conveniente disposto no sitio activo são necessárias três cadeias laterais que assegurem ligação, orientação no espaço e activação.
No caso da quimotripsina o imidazol da histidina assegura a ligação, o hidroxilo da serina a orientação e a triptofana a orientação.
Interacção enzima-substracto
Modelo chave-fechadura de Fischer
- Foi a primeira teoria apresentada
- Admitia que a proteína estaria pré-conformada para receber o substracto tal qual como a fechadura recebe a chave
Disposição induzida de Koshland
· É o modelo mais aceite
· O enzima sofreria uma alteração conformacional para se adaptar ao sitio activo
Este modelo permite uma adaptação perfeita do substracto ao enzima
Animações
Enzimas activos e inactivos
Pró-enzimas
Alguns enzimas encontram-se num estado inactivo, o pró-enzima ou zimogenio
No proenzima o enzima está ligado a um péptido que impede a sua actividade
Fosforilação
A fosforilação de alguns enzimas pode activa-los ou inactiva-los,. tendo a desfosforilação uma acção inversa
Na glicogénio sintetase a sua forma fosforilada é inactiva ao contrario da fosforilase
Enzimas monomericos
Têm apenas uma cadeia polipeptidica
Este grupo diz respeito a um numero pequeno de enzimas, todos actuando em reacções de hidrolise
Existem quase todos como pró-enzimas
Enzimas monomericos
Enzimas Numero de aminoácidos
Ribonuclease 124
Papaina 203
Tripsina 223
Enzimas oligomericos
São constituídos pela reunião de varias subunidades proteicas
As subunidades que se repetem chamam-se monómeros
Reacções em sequencia
No organismo geralmente os enzimas trabalham em sequencia de modo que o produto final de uma reacção se torna o substracto da seguinte, catalisada por outro enzima e assim sucessivamente
Estes sistemas podem organizar-se em vários modos
- As moléculas deslocam-se rapidamente de um enzima para outro, alinhados em sequencia
- Os enzimas reúnem-se na mesma molécula, tendo cada um um coenzima diferente - sistema polienzimatico
Muitos isoenzimas podem ser separados por electroforese
Enzimas diferentes com a mesma actividade
Enzimas totalmente diferentes
São enzimas de composição totalmente diferente com a mesma actividade
É o caso de duas malicodeidrogenases, uma citoplasmica e outra mitocondrial
Isoenzimas
São heteropolimeros, resultantes da associação diferente de varias subunidades
Diferenças no grupo prostetico
Neste caso a diferença reside no grupo prostetico
A fosfatase alcalina e a catalase têm subunidades com ou sem acido sialico
Variantes geneticas
Devido a mutações podem-se sintetizar enzimas com estrutura diferente, o que muitas vezes implica diferenças na sua actividade
Enzimas conjugados com outros grupos
Como vimos a fosforilase pode estar ou não fosforilada, com actividades biológicas diferentes
Capitulo 5
CINETICA ENZIMATICA
Textos
Velocidade de uma reacção enzimática
A velocidade de uma reacção enzimática é representada pela quantidade de produto formado ou consumido por unidade de tempo
Depende de:
· Concentração do enzima
· Concentração do substracto
· Afinidade do enzima pelo substracto
Concentração do enzima
Se a concentração do substracto se mantiver constante, a velocidade da reacção é proporcional à concentração do enzima desde que haja excesso de substracto
Esta proporcionalidade só se observa quando há excesso de substracto pois caso contrario quando todo o enzima se gastou forma-se um planalto
Concentração do substracto
Se a quantidade do enzima se mantiver constante e a do substracto for aumentando gradualmente a velocidade da reacção aumentará até atingir um máximo, a velocidade máxima
Após este ponto um aumento da concentração de substracto já não aumenta a velocidade porque todo o enzima existente já está combinado com o substracto
Quando a concentração do substracto é baixa a velocidade de reacção é directamente proporcional à sua concentração – reacção de ordem 1
Para concentrações elevadas de substracto, a velocidade de reacção é independente da concentração e tendem formar um planalto devido à concentração do enzima em substracto – reacção de ordem 0
KM
É a concentração de substracto correspondendo a metade da velocidade máxima
pH e temperatura
Tanto para o pH como para a temperatura há um valor ao qual actividade do enzima é máxima – pH e temperatura óptimos
cortesia de Michael Gregory
cortesia de Michael Gregory
Para cima e para baixo destes valores a actividade diminui, podendo chegar a ser nula
ANIMAÇÕES
Capitulo 6
ACTIVADORES E INIBIDORES
Activadores
Mecanismos da acção activadora dos iões
Favorecem a ligação enzima-substracto
Fazem parte essencial do sitio catalítico, funcionando como coenzimas
Removem inibições existentes
Activação por protecção do enzima
A cisteina e o glutatião protege os grupos SH da oxidação
Activação por actuação em subunidades
Alguns enzimas têm uma unidade reguladora R e uma catalítica C
Quando não combinada a subunidade R mascara a C e impede a acção do enzima
Quando combinada com o AMP cíclico liberta o sitio activo e permite a acção do enzima
Inibidores
Textos
Inibidor competitivo
Tem uma estrutura semelhante ao substracto
O sitio activo confunde-o com o substracto, impedindo a reacção
cortesia de Michael Gregory
Não se liga ao sitio activo
Afectam a estrutura primária do enzima, p.ex. destruindo ligações S-S
Animações
Reversíveis e irreversíveis
Inibidores irreversíveis
Formam ligações muito fortes que não são dissociáveis
Inibidores reversíveis
Formam ligações covalentes fracas que se dissociam facilmente
Inibição pelos produtos da reacção
Os produtos da reacção, devido a alguma semelhança com o substracto, quando em excesso podem inibir o enzima
Inibição por excesso de substracto
Quando a quantidade de substracto é muito grande, várias moléculas do substracto podem competir para o mesmo sitio activo
Retro-inibição
O produto final da cadeia enzimática pode regular a síntese de toda a cadeia por retro-inibição
inibição
Inhibitors of Oxidative Phosphorylation
Oxidação do NADH extra-mitocondrial
inibição
É por exemplo o caso da treonina
Animação
Efeito alostérico
Bibliografia
Em todas as reacções metabólicas há um enzima dotado de uma reactividade particular, em geral o primeiro da sequencia – é o enzima regulador
Este enzima é inibido apenas pelo produto final X mas não pelos intermediários A,B, etc. – é o efeito alosterico
Neste caso a molécula combina-se não com o sitio activo mas com um outro sitio, o sitio alosterico
A combinação com o sitio alosterico altera a conformação do enzima – transição alosterica
As moléculas que actuam sobre os sítios alostericos chamam-se efectores alostericos
O efector alosterico pode inibir a reacção (efector alosterico negativo) ou activa-la (efector alosterico positivo)
cortesia de Michael Gregory
cortesia de Michael Gregory
Animações
Capitulo 7
ESPECIFICIDADE DOS ENZIMAS
Os enzimas exibem especificidade em relação às reacções que catalisam
Especificidade absoluta
Catalisam apenas uma reacção
Especificidade de grupo
Catalisam reacções em moléculas com um determinado grupo funcional (amina,fosfato,etc)
Especificidade de ligação
Actua apenas sobre uma determinada ligação
Especificidade estereoquimica
Actua apenas sobre um estereoisómero
Capitulo 7
Classificação dos enzimas
Oxido- redutases
Catalisam reacções de oxidação-redução entre dois substractos.
As hidroxilases introduzem um oxidrilo
Os transportadores de electrões transportam electrões com mudança de valência do metal
Transferases
Transferem grupos funcionais de uma molécula para outra
Hidrólases
Catalisam uma cisão pela fixação de uma molécula de agua, ficando o OH de um lado da ligação e o H doutro
Liases
Acrescentam ou removem grupos de um substracto com a formação de uma dupla ligação
Isomerases
Catalisam rearranjos moleculares, formando isómeros
As racemases transformam um estereoisomero n
As isomerases cis-trans transformam isómeros cis em trans
ANIMAÇÕES
http://www.sp.uconn.edu/~terry/images/anim/ETS_fast.html
Inibidores
Inhibitors of Oxidative Phosphorylation
Name
|
Function
|
Site of Action
|
Rotenone
|
e– transport inhibitor
|
Complex I
|
Amytal
|
e– transport inhibitor
|
Complex I
|
Antimycin A
|
e– transport inhibitor
|
Complex III
|
Cyanide
|
e– transport inhibitor
|
Complex IV
|
Carbon Monoxide
|
e– transport inhibitor
|
Complex IV
|
Azide
|
e– transport inhibitor
|
Complex IV
|
2,4,-dinitrophenol
|
Uncoupling agent
|
transmembrane H+ carrier
|
Pentachlorophenol
|
Uncoupling agent
|
transmembrane H+ carrier
|
Oligomycin
|
Inhibits ATP synthase
|
OSCP fraction of ATP synthase
|
http://themedicalbiochemistrypage.org/oxidative-phosphorylation.html
Oxidação do NADH extra-mitocondrial
As mitocondrias não são permeáveis ao NADH.
Como as cadeias de oxi-redução são mitocondriais tem que haver mecanismos de transporte
Este mecanismo é caracterizado por dois mecanismos de vai-vem – glicerofosfato-fosfodihidroxiacetona no musculo e alfahidroxibutirico-alfa cetobutirico
Capitulo 7
FOSFORILAÇÃO OXIDATIVA
Donde provem a energia que os processos de síntese necessitam para a sua realização?
Nas plantas a energia provem da energia solar através da fotosintese
Nos animais provem pela formação no decorrer do catabolismo de ligações fosfato ricas em energia
Ligações fosfato ricas em energia
Tipos de ligação fosfato
Ligações de fraco potencial
A sua hidrolise liberta pouca energia
Ligações de forte potencial
A sua hidrolise liberta muita energia
Representam-se pelo sinal ~
Encontram-se na sua quase totalidade nos nucleotido trifosfatos e na fosfocreatina
Nucleotido-trifosfatos
No decorrer de algumas reacções metabólicas formam-se ligações fosfato ricas em energia, designadas por ~P.
Estas ligações quando hidrolisadas libertam energia.
Encontram-se no ATP, GTP e UTP
O mais importante dador de energia é o ATP
Fosfagéneos
No musculo a energia pode ser armazenada em moléculas que constituem o grupo dos fosfageneos
Quando o ATP se esgota após um esforço máximo e prolongado, as ligações de fosfato ricas em energia hidrolisam-se, formando-se energia
Quando o esforço cessa o ATP formado vai regenerar os fosfageneos
Nos vertebrados, os fosfageneos são representados pela fosfocreatina
Fosforilação ligada ao substracto
O ATP é formado quase exclusivamente pela fosforilação oxidativa, associada à cadeia de transporte de electrões
Nalgumas reacções catabolicas há um rearranjo molecular em que se forma directamente uma ligação de forte potencial – é a fosforilação ligada ao substracto
fosforilação ligada ao substracto
Visão geral
ATP
Fórmula
É um trinucleotido, a adenosina trifosfa
Funções
· É o dínamo energético do organismo pois é nele que se acumula a quase totalidade da energia formada no organismo
A sua hidrolise em ADP liberta 7,3 kcal
· Entra na síntese do RNA
· Regula muitas reacções metabólicas
Síntese
Forma-se por fosforilação do ADP
Necessita de energia – 7,3 kcal/mol
Faz-se nas mitocondrias
Na fotossíntese ocorre nos cloroplastos
ATP sintase
Também é conhecida por H+ ATPase ou FoF1-ATPase
Tem duas subunidades, a Fo que permite a passagem de protões através da membrana e a F1 que contem o sitio catalítico
Os seus inibidores são a oligomicina e a diciclohexilcarbodimida
ANIMAÇÕES
Transporte de ADP e ATP
A ATP translocase, situada na membrana interna das mitocondrias permite o transporte de uma molécula de ATP para o espaço intermembranario em troca com uma molécula de ADP
Uma outra proteína transportadora, a porina, permite que o ATP atravesse a membrana externa para se dirigir ao citoplasma
Fosforilação oxidativa
É o aproveitamento da energia libertada durante o transporte de electrões para formar ATP
A energia liberta-se em três pontos de associação – complexos I, II e IV
Os electrões que entram na cadeia pelo NADH formam 3 ATP
Os que entram pelo FAD formam 2
Inibidores da fosforilação oxidativa
Compounds
|
Use
|
Effect on oxidative phosphorylation
|
Poisons
| ||
Inhibits ATP synthase by blocking the flow of protons through the Fo subunit.[80]
| ||
Poisons
|
Ionophores that disrupt the proton gradient by carrying protons across a membrane. This ionophore uncouples proton pumping from ATP synthesis because it carries protons across the inner mitochondrial membrane.[82]
| |
Prevents the transfer of electrons from complex I to ubiquinone by blocking to the ubiquinone-binding site.[83]
| ||
Malonate and oxaloacetate
|
Competitive inhibitors of succinate dehydrogenase (complex II).[84]
|
Controle da fosforilação oxidativa
É controlada pela razão ADP/ATP
Quando o ADP está elevado aumentam as transferências de electrões a partir dos substractos disponíveis, passando-se o contrario quando o ATP está elevado
ANIMAÇÕES
CAPITULO 8
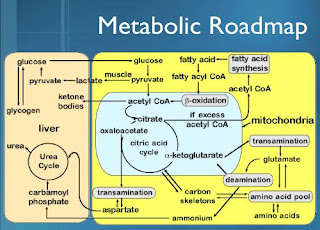
Ciclo de Krebs
Bibliografia
Conceito e funções
Conceito
Também é conhecido por ciclo dos ácidos tricarboxilicos ou ciclo do acido cítrico
É a via de oxidação final dos catabolitos
As reacções passam-se na matriz das mitocondrias
Funções
É o precursor de muitos compostos
Oferece um processo de degradação de muitos resíduos acetilo formados no catabolismo
Fornece a maior parte dos electrões para a cadeia respiratória
Etapas
Formação do acido cítrico
O acetil-CoA cede o acetilo a um acido com quatro carbonos, o acido oxaloacetico
O enzima é a citrato sintase ou enzima condensante
A energia para a reacçãoitrico é dada pela ruptura da ligação tioester do acetil-CoA
A reacção é inibida pelo ATP e NADH e estimulada pelo ADP
Isomerisação em acido isocitrico
Esta isomerisaçáo faz-se tendo como intermediário o acido aconitico
A reacção é catalisada pela aconitase
São necessários o Fe++ e o glutatião
A formação de ácidos tricarboxilicos – cítrico, isocitrico e aconitico- explica a designação de ciclo dos ácidos tricarboxilicos
Oxidação do acido isocitrico
A isocitricodeidrogenase catalisa a conversão do acido isocitrico em a-cetoglutaricocom o acido oxalosuccinico como intermediário
O acido isocitrico desidrogena-se em oxalosuccinico, sendo os hidrogénios transportados pelo NAD.
O enzima é activo como um dimero
O ADP permite a reunião dos dois monómeros
Esta etapa é fundamentalparaaregulação do metabolismo intermediário
No sector extra-mitocondrial sintetisa-se acido isocitrico que não é activado pelo ADP e utilisa NADP
Não entra no ciclo de Krebs, sendo uma fonte de NADP reduzido
Formação de succinil-CoA
É realizada por um complexo polienzimatico que compreende apoenzima, difosfato de tiamina (DTP),acido lipoico, CoA e magnésio formando-se o sucinil-CoA
O acido lipoico é um acido de oito carbonos saturado em que o C6 e o C8 estando ligados por uma ligação S-S formando um anel com cinco membros
cortesia de Ben Best
Nesta descarboxilação oxidativa entram três enzimas (descarboxilase, lipoil redutase e transsucinilase) e cinco coenzimas agrupados num complexo multienzimatico
Formação do acido sucinico
A sucinato tioquinase liberta o CoA do sucinil-CoA com a formação intermediaria de sucinil-fosfato
A energia libertada pela ligação de forte potencial é inicialmente captada pelo GTP sendo em seguida transferida para o ADP
Há uma via alternativa nos tecidos extra-hepaticos, ligada à utilização dos corpos cetonicos
Formação do acido fumarico
O acido sucinico transforma-se em fumarico pela acção da sucinico-deidrogenase
O enzima contem quatro moléculas de ferro e FAD
É inibida pelo acido maleico( isómero cis) e pelo acido malonico
Formação do acido malico
O acido fumarico é hidratado em malico pela acção da fumarase
Formação do acido oxaloacetico
A malicodeidrogenase desidrogena o acido malico em oxaloacetico, recomeçando um novo ciclo.
O hidrogénio é transportado pelo NAD
Visão geral
ANIMAÇÕES
Reacções anapleroticas
Bibliografia
Definição
Reacções que originam intermediários do ciclo de Krebs, permitindo um maior processamento do metabolismo do acetil-CoA
Algumas reacções anapleróticas
From
|
To
|
Reaction
|
Notes
|
pyruvate + HCO3- + ATP
|
This reaction is catalysed by pyruvate carboxylase, an enzyme activated by Acetyl-CoA, indicating a lack of oxaloacetate. It occurs in animal mitochondria. Most important anaplerotic reaction depending on severity, deficiency causes lactic acidosis, severe psychomotor deficiency or death in infancy [1]
| ||
-
|
This is a reversible reaction forming oxaloacetate from aspartate in a transamination reaction, via aspartate transaminase.
| ||
-
|
When odd-chain fatty acids are oxidized, one molecule of succinyl-CoA is formed per fatty acid. The final enzyme is methylmalonyl-CoA mutase. Triheptanoin (fat with three heptanoic (C7:0) fatty acids) may be used to treat pyruvate carboxylase deficiency
| ||
adenylosuccinate
|
This reaction is catalysed by adenylosuccinate lyase and occurs in purine synthesis and purine nucleotide cycle. Defect of this enzyme [2] causes psychomotor retardation.
|
Vai-vem do glicerofosfato
Utiliza a porina, um transportador externo que troca pequenas moléculas de um lado e do outro das mitocondrias
Se a razão NADH/NAD no citoplasma se eleva pela acção das deidrogenases, o NAD deidrogenase citoplasmica reduzirá a fosdihidroxiacetona em glicerofosfato
Este glicerofosfato entrará nas mitocondrias para a glicerofosfato deidrogenase mitocondrial reformar a fosfodihidroxiacetona que será trocada contra o glicerofosfato acabado de entrar
Vai-vem malato-aspartato
No citossol a redução do oxaloacetato em malato pela malato deidrogenase assegura a oxidação do NADH em NAD
O malato é transportado em seguida para as mitocondrias onde uma MDH o oxida em oxaloacetato com a redução do NAD em NADH
Como o oxaloacetato não atravessa a membrana mitocondrial é transaminado em aspartato que atravessa a membrana
No citossol o aspartato é transaminado em oxaloacetato
Este ciclo permite transferir um NADH para as mitocondrias, com um ganho subsequente de
oxaloacetato com a redução do NAD em NADH
Como o oxaloacetato não atravessa a membrana mitocondrial é transaminado em aspartato que atravessa a membrana
Ciclo de Krebs, placa giratória do metabolismo
O ciclo de Krebs é alimentado por compostos vindos de outros metabolismos
Por outro lado alguns dos seus constituintes participam em reacções de síntese
Capitulo 9
PATOLOGIA DA CADEIA RESPIRATORIA E DO CICLO DE KREBS
Envenenamento pelos cianetos
O cianeto é um veneno letal de acção muito rápida, muito usado pelos espiões
É um inibidor do citocromo a3
A morte surge por falta de oxigenação dos tecidos
A morte só se pode evitar nos primeiros momentos da sua administração formando metahemoglobina pela administração de nitritos pois esta compete com o citocromo a3 formando o complexo<metahemoglobina-cianeto
Uma outra solução é a administração de tiosulfatos que pela acção do enzima rodanese forma um tiocianato não tóxico
Venenos de plantas e ciclo de Krebs
Algumas plantas contêm fluoroacetato
Quando ingerido forma-se fluoroacetil-CoA que toma o lugar do acetil-CoA, formando-se fluoro~citrato
O fluorocitrato é um inibidor da aconitase, impedindo a continuação do ciclo de Krebs
Deficiência em fumarase
São raras deficiências em enzimas do ciclo de Krebs
Descreveram-se alguns casos de deficiência em fumarase
A urina contem uma grande quantidade de fumarato
Observam-se sinais de lesão do sistema nervoso
Deficiência da piruvico deidrogenase
A deficiência de qualquer dos componentes deste complexo multienzimatico está associada a acidose láctica e disfunção do sistema nervoso central
O prognostico é mau
Doença de Leigh
É uma doença neurológica grave
Deve-se a disfunções no complexo IV ou no I
Insulina
Acção indirecta
Estimula o metrabolismo dos glucidos aumentando assim a produção de energia
Acção directa
Estimula a actividade das mitocondrias
Tiroideia
A tiroxina dissocia a fosforilação oxidativa e o transporte de electrões, havendo assim uma grande dissipação do calor no hipertiroidismo
Vitamina A
É necessária uma concentração óptima desta viamina para o bom funcionamento das membranas mitocondriais.
Acima e abaixo desta concentração há modificações funcionais dos enzimas associados às fosforilações oxidativas
Cirrose hepática
´
A produção do ATP no fígado diminui 30%












































Sem comentários:
Enviar um comentário