METABOLISMO DOS AMINOACIDOS
Destino dos grupos amina
Destino da amonia
Patologia da amonia
Eliminação do carboxilo
Grupos metabolicamente activos
Glicina
Patologia da glicina
Serina
Treonina
Aminoacidos ramificados
Patologia dos aminoacidos ramificados
Lisina
Patologia da lisina
Ãrginina e ornitina
Acido glutamico
Histidina
Patologia da histidina
Prolina e hidroxiprolina
Patologia da prolina e hidroxiprolina
Aminoacidos com enxofre
Patologia dos aminoacidos com enxofre
Fenilalanina e tirosina
Patologia da fenilalanina e tirosina~
Triptofana
Patologia da triptofana
Digestao das proteinas
Metabolismo da hemoglobina
Patologia dos eritrocitos
Sintese dos nucleotidos puricos
Sintese dos nucleotidos pirimidicos
Metabolismo das bases puricas
Patologia das purinas
Formação de desoxiribonucleotidos
Formação de outros nucleotidos
Catabolismo dos acidos nucleicos e nucleotidos
Revisões de conjunto
Capitulo 1
DESTINO DOS GRUPOS AMINA
Revisões de conjunto
Nomenclatura
Os aminoácidos são ingeridos na sua quase totalidade como proteínas, necessitando estas de ser hidrolisadas pelos enzimas digestivos.
1 a 2% das proteínas são recicladas diariamente, dando origem aos seus aminoácidos constituintes. 75 a 80% destes aminoácidos são reutilizados para a síntese de novas proteínas, sendo os 20 a 25% restantes catabolisados.
Os aminoácidos fornecidos em excesso na alimentação não são aproveitados, sendo catabolisados.
Tendo os aminoácidos uma parte comum (amina e carboxilo) e uma parte diferente (grupo R) serão considerados separadamente o metabolismo de cada uma destas partes (metabolismo geral e metabolismo especial)
Desaminação oxidativa
Natureza da reacção
A não ser no caso dos aminoácidos - álcoois ( serina, treonina) esta desaminação é oxidativa pois a remoção do grupo amina está associada à perda de dois hidrogénios. A reacção faz-se em duas fases
- Desidrogenação com formação de uma imina
- Os hidrogénios são captados por uma flavoproteína.
- Remoção do grupo amina com formação do acido α-cetónico correspondent
D – aminoácido – oxidases
Encontram-se espalhadas por todo o organismo, embora o seu papel ainda hoje não seja conhecido pois actuam sobre aminoácidos não existentes no organismo, os da série D.
O seu coenzima é a FAD.
L – aminoácido – oxidases
Embora actuem sobre aminoácidos naturais, a sua concentração nos tecidos é muito reduzida.
O seu coenzima é a FMN.
Glicocola–oxidase
É um enzima pouco importante.
Só actua sobre a glicocola, transformando-a em ácido glioxílico
Glutamico-deidrogenase
É um enzima muito espalhado, de importância metabólica fundamental.
Desamina o ácido glutâmico em ácido α-cetoglutárico
Utiliza tanto a NAD como a NADP
A reacção é reversivel
Está sujeito a uma regulação alostérica.
O ADP e GDP são efectores positivos e o ATP e GTP efectores negativos, o que significa que o enzima é activado quanto o aporte energético é insuficiente e inibido no caso contrário.
Desaminação não oxidativa
Nos aminoácidos-alcool ( serina, treonina) formam-se ácidos cetonicos por desaminação não acompanhada de oxidação porque estes já têm um OH na sua estrutura
Desamidação
A glutamina e a asparagina têm radicais amida.
A glutaminase e asparaginase catalisam a hidrolise que liberta este radical
http://ead.univ-angers.fr/~jaspard/Page2/COURS/2N2NH3aaetUree/1N2NH3AAetUree.htmTransaminação
Conceito
É uma reacção de transferência de um grupo amina de um aminoacido para um ácido α-cetónico aceitador para originar um outro aminoácido e um outro ácido α-cetónico
É a reacção mais importante do metabolismo dos aminoácidos.
Pode realizar-se em todos os aminoácidos, excepto a prolina, lisina e treonina.
Tem como coenzima o fosfato de piridoxal
Nomenclatura
Os enzimas catalisando esta reacção são geralmente conhecidos como transaminases embora pela nomenclatura da União Internacional de Bioquímica se devam designar como aminotransferases.
Para designar a aminotransferase, usa-se o nome dos aminoácidos implicados na reacção Assim o enzima catalisando a reacção
Ácido glutamico + ácido pirúvico → ácido α-cetoglutárico + alanina
designar-se-ia como glutamico-alanina aminotransferase, mas é mais comum usar a designação trivial de transaminases.
Neste case utilizam-se o nome dos compostos do lado esquerdo da equação
No exemplo anterior o enzima designar-se-ia transaminase glutamico-pirúvica.
ANIMAÇÕES
Transdesaminação
O contraste entre a fraca actividade das L-aminoacido desaminases (exceptuando a glutamico-deidrogenase) e a grande actividade das desaminases são a favor da ideia que estes enzimas possam actuar associados
De facto a maior parte dos aminoácidos é degradada por desaminação oxidativa indirecta graças à associação transaminases-glutamico-deidrogenase - é a transdesaminação
ANIMAÇÕES
Capitulo 2
DESTINO DA AMONIA
No decorrer do metabolismo dos aminoácidos forma-se o grupo amina que em contacto com a agua se transforma em amónia
A amónia é tóxica porque desloca para a esquerda a reacção catalisada pela glutamicodeidrogenase, acarretando uma menor produção de acido alfa-cetoglutarico com a consequente menor alimentação do ciclo de Krebs
Vias de eliminação da amónia
- Áminação de cetoacidos
- Formação de glutamina
- Formação de ureia, a via mais importante
Aminação de cetoácidos
Passa-se essencialmente com os ácidos alfa- cetoglutarico e oxaloacetico
Formação de glutamina
A glutamina comporta-se como uma reserva de amónia
Síntese da ureia
Bibliografia
Formação do carbamilfosfato
O bicarbonato combina-se com a amónia e o ATP para formar carbonil-fosfato
A reacção é catalisada pela carbamil-fosfato sintetase (CPS) I, mitocondrial
Existe uma CPS II, citoplasmica que entra na síntese das pirimidinas
Formação de citrulina
O carbamilfosfato combina-se com a ornitina parta dar citrulina pela acção da ornitina-carbamiltransferase
A energia é fornecida pela ligação fosfato de forte potencial do carbamilfosfato
Formação de arginino-succinato
Forma-se por condensação da citrulina com o aspartato pela acção da argininosuccinato sintetase
A citrulina atravessa a membrana mitocondrial pela acção da citrulina-ornitina translocase
Formação de arginina
A arginino-sucinato liase cinde o arginino-succinato em arginina e fumarato
O fumarato através do ciclo de Krebs forma o oxaloacetato que por transaminação regenera o aspartato
Formação de ureia
A argina cinde-se em ornitina, que entrará num novo ciclo, e em ureia, pela acção da arginase
Locais da síntese
A sintese faz-se parcialmente no citoplasma e parcialmente nas mitocôndrias
Capitulo 3
PATOLOGIA DA AMONIA
Formação patologica da amónia
Causas
Para lá da amónia formada nos tecidos, uma grande quantidade é formada no intestino pelas bactérias intestinais.
Esta amónia é absorvida pelo intestino e vai para o fígado que a remove da circulação pelos mecanismos já estudados, nomeadamente pela formação de ureia
Quando a função hepática está gravemente alterada ou há um shunt entre a veia porta e a circulação sistémica a amónia entra na circulação e produz sinais graves de intoxicação.
Toxicidade da amónia
A amónia é tóxica pelas seguintes razões..
- Aminação do acido a- cetoglutarico em glutamico com a consequente redução do ciclo de Krebs
- Inibição da isocitrico deidroghenase com acumulação de acido cítrico que irá inibir a fosfofrutocinase e portanto a glicolise
- Aumento da degradação dos coenzimas piridinicos
São assim afectados o ciclo de Krebs, glicolise e cadeia respiratória
Tratamento
- Diminuição da ingestão de prótidos
- Diminuição da actividade bacteriana pela administração de antibióticos
- Estimulação da ureogenese pela administração de argininna ou carbamilglutamato
- Estes tratamentos são apenas sintomáticos não actuando sobre a causa da doença hepática
Erros da ureogenese
Tipos
Os erros da ureogenese são:
- Hiperamoniemia tipo I
- Hiperamoniemia tipo nII
- Citrulinemia
- Aciduria arginino-sucinica
- Hiperargininemia
A intoxicação pela amónia é mais intensa quando o bloqueio surge antes da formação de citrulina (hiperamoniemias I e II ) pois nas outras formas os compostos formados podem formar ligações covalentes com a ureia
Sintomas
Vómitos, astenia, letargia, atraso mental
Tratamento
- Alimentação pobre em proteínas
- Alimentação fraccionada para evitar grandes subidas de amónia
Capitulo 4
ELIMINAÇÃO DO CARBOXILO
É feita por descarboxilação dos aminoácidos, originando aminas por descarboxilases especificas, que necessitam de fosfato de piridoxal
As aminas formadas são destruídas por diaminooxidases
Capitulo 5
GRUPOS METABOLICAMENTE ACTIVOS
Transmetilações
Os grupos metilo não são sintetizados no organismo.
São transferidos de moléculas que os contêm (dadores de metilo) para outras que os aceitam (aceitadores de metilo) por um processo de transmetilação
Metionina
Precisa de ser activada na sua forma activa, a S-adenosilmetionina pelo enzima activador da metionina
A sua desmetilação origina a S- adenosilhomocisteina
Colina e betaina
Agem como dadores indirectos na medida em que os metilos libertados vão metilar a homocisteína
Cria-se assim um ciclo do metilo
O transporte dos metilos necessita de acido tetrahidrofolico FH4
Transferências de corpos em C1
No decorrer do metabolismo dos aminoácidos formam-se corpos em C1
- Metilo – CH3
- Metileno – CH2
- Metenilo - CH
- Formilo O=CH
- Formimino -CH-NH
- Estes corpos em C1 necessitam de FH4
Tambem se forma CO2, que necessita de fosfato de piridoxal
Formação de FH4
Forma-se a partir do acido folico pela acção da hidrofolato redutase, na presença de \acido ascórbico.
Os hidrogénios são fornecidos pelo NADPH
O metotrexato é um inibidor competitivo da hidrofolico redutase, sendo por essa razão usado como antitumoral
Os radicais são interconvertiveis
Transporte
Os radicais a ser transportados combinam-se com o N5 ou N10 do FH4
Transamidinação
É a transferência do grupo amidina, catalisada pela transamidinase
Ciclo do glutamilo
Trata-se da transferência do grupo glutamilo do glutatião ou glutamina para aminoácidos ou péptidos pela glutamiltransferase
Os gama-glutamil- péptidos estão envolvidos no transporte de aminoácidos pelo rim
Neste sistema a gamaglutamiltransferase (gGT) associa-se á gGTciclotransterase(gGC)
Regeneração do glutatião
No rim, a cisteina, glicina e acido glutamico regeneram o glutatião
GLICINA
Interacções com a serina
A glicina não é um aminoácido essencial pois pode ser formada a partir da serina
Por outro lado a sua maior via de degradação é a conversão em serina
Sistema de clivagem da glicina
Para a glicina se converter em serina é necessário CHOH que é fornecido pela clivagem de outra molécula de glicina através do sistema de clivagem da glicina
Desaminação
A glicina oxidase desamina a glicina em acido glioxilico
Embora a glicina se possa converter em acido glioxilico, a via normal de degradação do acido glioxilico é a conversão em glicina
Quando falta o enzima este transforma-se em acido oxalico, surgindo a hiperoxaluiria primaria, doença grave que causa cálculos renais e pode levar à morte por insuficiência renal
Síntese do glutatião
Síntese do acido hipúrico
Resulta da combinação da glicina com o acido benzóico
Neoglicogenese
Entra na neoglicogenese pela sua conversão em acido piruvico
Capitulo 7
PATOLOGIA DA GLICINA
Hiperglicinemia
Hiperglicinemia cetosica
Surge na deficiência em propionil-CoA carboxilase que causa a acidemia propionica.
Não se sabe porque surge a hiperglicinemia
Como se acompanha de cetose designa-se por hiperglicinemia cetosica
Hiperglicinemia não cetosica
Falta o enzima de clivagem da glicina
A forma mais frequente é a neonatal
Surge entre as 6 horas e 8 dias após o nascimento
Há falta de sucção, hipotonia profunda,convulsões
Pode conduzir ao coma e à morte
Nenhum tratamento é conhecido
Nos doentes com formas mais moderadas, os medicamentos que se opõem à acção da glicina sobre as células neuronais ( estricnina, diazepam, dextromorfano) podem ter algum efeito
Hiperoxaluria
Causa
Falta a alanina-glioxilato aminotransferase
O enzima encontra-se apenas nos microssomas do fígado
O acido glioxilico não é metabolisado e transfere-se para o citossol onde é transformado em acido oxálico
Sintomas
O oxalato de cálcio é relativamente insolúvel depositando-de no rim
Surgem cálculos renais, nefrocalcinose e insuficiência renal
A insuficiência renal agrava-se progressivamente, levando à morte geralmente antes dos 20 anos
Tratamento
Não há tratamento eficaz
Os transplantes renais não actuam mas descreveram-se bons resultados com transplantes de fígado e rim
Bibliografia
Capitulo 8
SERINA
Síntese
Origina-se a partir do acido fosfoglicerico, formado na glicolise
Desaminação
Converte-se em piruvato pela serina deidrase
Descarboxilação
Descarboxila-se em etanolamina, que, por metilações sucessivas originará a trimetiletanolamina ou colina
Outras actividades metabólicas
- Neoglicogenese por conversão em acido piruvico
- Síntese da esfingosina
- sintese da cisteina
- conversão em glicina
- síntese das pirimidinas
Capitulo 9
TREONINA
É um aminoácido essencial
Cisão em glicina e acetaldeido pela acção da treonina aldolase. O acetaldeido converte-se em acetilCoA
Desaminação em acido alfa-cetobutirico que se descarboxila em acido propionico, originando este o sucinil- CoA
Capitulo 10
AMINOÁCIDOS RAMIFICADOS
(leucina, isoleucina, valina)
São aminoácidos essenciais.
O catabolismo destes três aminoácidos segue os mesmos passos, evidentemente com a formação de intermediários diferentes
Etapes do catabolismo
Transaminação
Formam-se os ácidos cetónicos correspondentes.
Como a reacção é reversível, estes cetoácidos podem substituir, na alimentação, os aminoácidos correspondentes
Descarboxilação oxidativa dos acidos cetónicos.
Esta reacção é catalisada por um complexo multienzimático mitocondrial que actua sobre os três ácidos cetónicos, a desidrogenase dos ácidos cetónicos de cadeia ramificada (BCKDH) Aleucina origina o isovaleril-CoA, a isoleucina o metilbutirilCoA e a valina o isobutirilCoA.
A estrutura e sistema de regulação deste enzima é semelhante à piruvico-deidrogenase.
O enzima é inactivado quando fosforilado por uma cinase e reactivado por uma fosfatase cálcio-independente.
Pelo seu lado a cinase é inibida pelo ADP, ácidos cetónicos de cadeia ramificada, alguns hipolipemiantes e tioesteres do CoA.
Catabolismo dos ácidos cetonicos
Após várias transformações, o isovaleril CoA origina o acetil-CoA e o acido acetoacetico
O metilbutiril CoA origina o acido propionico que se poderá transformar em sucinil-CoA
O isobutiril-CoA origina o sucinil-CoA
Acção metabólica
Como consequência deste catabolismo, a leucina é cetogenica e os outros dois aminoácidos, glicogenicos
CAPITULO 11
PATOLOGIA DOS AMINOACIDOS RAMIFICADOS
Doença do xarope de acer
Bibliografia
Forma clássica
Falta o complexo enzimático que descarboxila os ácidos cetonicos, a BKCDH.
Os ácidos cetonicos ramificados são eliminados pela urina dando-lhe um cheiro característico, comparado ao do xarope de acer.
A doença é fatal se não forem removidos rapidamente os ácidos ramificados.
Como a sua depuração renal é reduzida deve-se recorrer à diálise peritoneal ou à hemodiálise
Após a recuperação deve-se instituir uma dieta pobre nestes aminoácidos.
Como estes aminoácidos são essenciais devem-se adicionar pequenas quantidades à dieta
Quando o aporte de leucina não atinge o mínimo necessário pode surgir acrodermatite enteropatica
Forma intermitente
As crianças aparentemente normais após um stress como febre ou cirurgia desenvolvem a forma clássica, podendo mesmo ocorrer a morte
O tratamento da fase aguda é idêntico
Após a recuperação, embora seja tolerada uma dieta normal, é recomendável uma dieta pobre nestes aminoácidos
Forma moderada
As manifestações são insidiosas e ligadas ao sistema nervoso central
O tratamento é o mesmo
Acidemia isovalerica
Deficiência da isovalerilCoA deidrogenase
Nas formas agudas observa-se vómitos, acidose severa, convulsões e coma
Também existe uma forma intermitente
O tratamento da fase aguda incide no tratamento da hidratação, fornecimento de calorias adequadas de forma oral ou intravenosa, correcção da acidose metabólica pela administração de bicarbonato
Também se deve remover o acido isovalerico em excesso
Uma solução é a administração de glicina(250mg/kg/dia) formando-se a isovalerilglicina que tem uma depuração urinaria elevada
A carnitina(100mg/kg/dia) também está indicada, por formar isovalerilcarnitina que é excretada pela urina
Depois da recuperação está indicada uma dieta pobre em roteínas e suplementosde glicina e carnitina
Bibliografia
Deficiência em metilcrotonil-CoA-carboxilase
As manifestações clínicas são variadas podendo ser fatais com acidose, convulsões e hipotonia grave
Os episódios agudos tratam-se com hidratação, infusão intravenosa de glicose e alcalinos.
O tratamento a longo prazo implica uma dieta pobre em leucina e administração oral de carnitina
Hipervalinemia
Falta a transaminase da valina
CAPIT ULO XIA
Acidemia propiónica
Causas
Defeito da propionato carboxilase cujo coenzima é a biotina
Acumulam-se produtos tóxicos nos gânglios basais
Sintomas
Infarto bilateral dos gânglios basais
Convulsões, vómitos, letargia, desidratação, cetoacidose
Tratamento
Alimentação pobre em proteínas
Carnitina, para melhorar o metabolismo dos ácidos de longa cadeia
Biotina, coenzima da carboxilase.
Esterilização da flora intestinal, produtora de acido propionico

Capitulo 12
LISINA
É um aminoácido essencial.
Entra na composição do colagénio após ser convertida em hidroxilisina.
Formação de ácido glutárico
A lisina transforma-se em ácido glutárico tendo como intermediários os ácidos α-aminocetoadípico e α –cetoadípico
O ácido glutarico na forma de glutaril-CoA cindir-se-á em malonil-CoA
Formação de sacaropina
É a via catabolica mais importante
Forma-se por condensação da lisina com o ácido α-cetoglutárico pela acção lisina- a-cetoglurarico-reductase.
A sacaropina transforma-se no semialdeido aminoadipico que após vãrias transformações originará duas moleculas de acetil-CoA.
Formação de ácido pipecólico
A lisina através de uma série de intermediários cicliza-se em acido pipecolico
O ciclo cinde-se para formar o semialdeido a-aminocetoadipico
Este cinde-se em duas moléculas de acetil-CoA
Capitulo 13
PATOLOGIA DA LISINA
Sacaropinuria
Não se efectua a degradação da sacaropina por falta da lisina-alfacetoglutarato deidrogenase e da sacaropina deidrogenase
Lisinemias
Bibliografia
Falta a lisina-cetoglutarato redutase que catalisa a condensação da lisina com o acido alfacetoglutarico na via da sacaropina
CAPITULO 14
ARGININA E ORNITINA
Bibliografia
A ornitina por descarboxilação origina a putrescina e a arginina a agmatina.
Na ureogenese a arginina cinde-se em ornitina e ureia.
Combina-se com a glicina para formar a creatinina
CAPITULO 15
PATOLOGIA DA ORNITINA
Ornitinemia
Deficiência em ornitina-aminotransferase
Causa uma entidade clínica bem definida caracterizada por uma atrofia da coroideia e da retina
Há uma perda progressiva de visão que leva à cegueira na quarta década da vida
A progressão da doença pode ser travada por restrição em ornitina e administração de vitamina B6
Capitulo 16
ÁCIDO GLUTAMICO
Bibliografia
Tem uma situação fulcral nas reacções de transaminação, funcionando com qualquer aminoácido e também em associação com a glutamico deidrogenase nas reacções de transdesaminação
R1-amino acid + R2-α-ketoacid ⇌ R1-α-ketoacid + R2-amino acid
Alanine + α-ketoglutarate ⇌ pyruvate + glutamateAspartate + α-ketoglutarate ⇌ oxaloacetate + glutamate
A sua amida, a glutamina, é transportadora de amónia e dadora de NH3
É constituinte do glutatião e dos ácidos fólicos
Participa em certos processos de destoxificação como a combinação com o ácido fenilacético para originar fenilacetilglutamina, sua via de eliminação
Biosintese
→ Glu + NH3
| ||
→ Glu + Acetate
|
(unknown)
| |
→ Glu + NADP+ + H2O
| ||
→ Glu + α-keto acid
| ||
→ Glu + NADH
| ||
→ Glu + 5-formimino-FH4
| ||
NAAG
|
→ Glu + NAA
|
Metabolismo no S.N.C.
No sistema nervoso central o ácido glutamico é descarboxilado pela c-glutamato descarboxilase, em ácido c-aminobutírico (GABA) na presença de fosfato de piridoxal
. O GABA é um neurotransmissor.
O GABA também se pode formar pela desaminação da putrescina pela diamino-oxidase
GABA e ciclo de Krebs
O GABA pode transaminar-se em semialdeido succinico pela acção da GABA transaminase.,indo transaminar o acido alfacetoglutarico para formar acido glutamico
O semialdeido succinico pode oxidar-se em ácido succinico ou pela acção da lactico-deidrogenase e dar de novo o GABA
O semialdeido succinico ao converter-se em ácido succcinico, completa um desvio do ciclo de Krebs pelo qual o ácido α-cetoglutárico em vez de originar directamente o ácido succinico, fá-lo através do ácido glutâmico, GABA e semialdeido sucínico
Formação do acido alfa-glutaramico
- A glutamina pode transaminar-se em acido alfacetoglutaramico
- Este acido aparece aumentado mais de 10 vezes nos doentes com coma hepático
- A sua perfusão no ventrículo lateral de ratos diminui a actividade locomotora e causa mioclono
Capitulo 17
HISTIDINA
A histidina é um aminoácido essencial, precursor das bases púricas.
Bibliografia
Descarboxilação
A histamina é libertada nos fenómenos alérgicos e estimula fortemente a secreção gastrica
Desaminação
Desamina-se em acido imidazol-piruvico
Este pode-se descarboxilar em imidazol-acetico
O acido imidazol-acetico tambem se pode produzir pela descarboxilação da histamina
Formação de acido glutamico
É a via mais importante
A histidase desamina não oxidativamente a histidina em acido urocanico
A urocanase hidrata o acido urocanico em imidazol-propionico
A imidazol hidrolase cinde o ciclo imidazol, formando-se o acido formiminoglutamico (FIGLU)
Este cede o formimino ao FH4 formando-se acido glutamico e formimuino-FH4, este ultimo necessário para a síntese das purinas
Capitulo 18
PATOLOGIA DA HISTIDINA
Histidinemia
É devida à falta da histidinase
Metade dos casos descritos tem atraso mental e dificuldades na fala
Na carência de ácido fólico não se forma formimino-FH4, acumulando-se o FIGLU cujo aumento é considerado como um sinal desta carência.
Doença de Canavan
Na doença de Canavan falta a aspartil acilase, sendo acompanhada da degenerescência da substancia branca do cerebro
1 em 5000 judeus askhenazi têm esta doença e 1 em 38 são portadores
Bibliografia
Deficiencia em urocanase
- Manifesta-se por dificuldades de aprendizagem e concentração
- Atraso mental
- Atraso de crescimento
- Olhos azuis
Bibliografia
Carnosinemia
Deve-se à deficiência em aminoacilhistidina dipeptidase
Caracteriza-se por:
- Hipotonia
- Atraso mental
- Neuropatia semsorial
- Tremores
- Desmielinização
- Anomalias da matéria cincenta
- Convulsões mioclonicas
Bibliografia
Capitulo 18
PROLINA E HIDROXIPROLINA
A hidroxiprolina é um constituinte importante do colagénio.
Não são aminoácidos essenciais
Têm um papel importante na estrutura do colagenio
Síntese
Prolina
A prolina sintetiza-se a partir do semialdeido glutamico que pode ser originado pelo ácido glutamico por redução ou pela ornitina por transaminação
O semialdeido em seguida cicliza-se em ácido pirrolidona-carboxilico que depois se reduz em prolina
Hidroxiprolina
Sintese
A hidroxiprolina forma-se por hidroxilação da prolina, já depois deste aminoácido estar incorporado na cadeia proteica.
Catabolismo
Prolina
Segue a via inversa à sua síntese
Hidroxiprolina
A maior parte e catabolisada não na forma livre mas sob a forma de um péptido com hidroxiprolina
Parte da hidroxiprolina é catabolisada por uma via igual à da prolina
Capitulo 20
PATOLOGIA DA PROLINA E HIDROXIPROLINA
Bibliografia
Hiperprolinemia tipo I
Falta a prolina oxidase
Hiperprolinemia tipo II
Falta a pirrolidona carboxilico deidrogenase
Hidroxiprolinemia
Falta a hidroxiprolina oxidase
Degradação do colagénio
A hidroxiprolina aumenta nas doenças em que há degradação do colagénio
Bibliografia
AMINOÁCIDOS COM ENXOFRE
Capitulo 21
AMINOÁCIDOS COM ENXOFRE
Bibliografia
Dos vários aminoácidos com enxofre só a metionina é essencial
A metionina pode-se converter nos outros aminoácidos com enxofre
A maior parte dos enzimas contem grupos sulfidrilo da cisteina, que conferem uma função protectora
Interconversões
Embora a metionina seja essencial, pode formar-se parcialmente por metilação da homocisteina.
A homocisteina e a metionina reagem através das suas formas activas, a S-adenosilhomocisteina e a S-adenosilmetionina, respectivamente
A betaina e a colina são fontes importantes de metilos
Formação da cisteína
A cisteina forma-se por conjugação da homocisteina com a serina.
Forma-se inicialmente cistationina que posteriormente se cinde por hidrólise em cisteina e homoserina
A homoserina desamina-se nem ácido α-cetobutirico que em seguida originará propionil-CoA
Transaminação
A cisteina-glutamato-aminotransferase transamina a cisteina em ácido sulfinilpiruvico.
Este transforma-se em piruvato e SH2 pela acção da tiol-pirúvico-transsulfurilase na presença de glutatião reduzido
L-cysteine + 2-oxoglutarate = mercaptopyruvate + L-glutamate.
| ||
Metabolismo do SH2
O SH2 é oxidado em SO2 e este em SO4
O SO4 será excretado ou se transformará na sua forma activa o fosfoadenosina-fosfosulfito ou PAPS.
A formação de PAPS necessita de ATP
Oxidação
O SH da cisteina pode-se oxidar em SO3H2 originando o ácido cisteico
O acido cisteico descarboxilar-se-á em taurina
A cisteina pode oxidar-se em cistina formando-se uma ponte S-S
Se esta oxidação se fizer numa cisteina situada no centro activo de um enzima, este ficará inactivo
Descarboxilação
A descarboxilação da cisteina origina a mercaptoetanolamina
Funções do SH na estabilidade dos enzimas
Muitas enzimas necessitam de um grupo SH livre para exercerem a sua actividade.
A oxidação do SH inactiva o enzima
Os metais pesados( mercúrio, arsénio) combinam-se com o SH inactivando os enzimas que o contêm.
O glutatião reactiva o SH por redução do S-S.
Nas reacções em que intervém o coenzima A, a combinação deste com o substracto faz-se no grupo SH que é parte integrante da estrutura do CoA.
Funções de conjugação
A cisteina pode-se combinar com halogénios para formar ácidos mercapturicos
A taurina combina-se com os ácidos biliares para formar p.ex. o ácido taurocólico.
Capitulo 22
PATOLOGIA DOS AMINOACIDOS COM ENXOFRE
Bibliografia
Homocistinemia
Bibliografia
Deficiência em homocisteina tionase
Acumula-se homocisteina e por remetilação desta metionina
A homocisteina pode reagir com os grupos lisil do colagenio
Sintomas
Observa-se deslocamento do cristalino após os 3 anos e osteoporose na criança
Nalguns casos o atraso mental é o primeiro sintoma
Tratamento
Tentou-se como terapêutica a restrição de metionina e a alimentação com betaina ou colina
Nalguns casos obtiveram-se bom resultados com vitamina B6
Actualmente há dados consistentes sobre a causa ser uma deficiência em folato, sugerindo a administração de folato como via de tratamento
Cinco defeitos enzimáticos diferentes podem interferir na formação de metilcobalamina
Os doentes têm vómitos, letargia, hipotonia e atrasos no desenvolvimento
O laboratório revela uma anemia megaloblastica
Tratam-se com a administração de vitamina B12
Bibliografia
Deficiência em metileno- tetrahidrofolato redutase
Na deficiência total há apneia neonatal e convulsões que podem levar rapidamente à morte
Na deficiência parcial observa-se um quadro crónico com atraso mental, convulsões,microcefalia e espasticidade
Trata-se com a administração precoce de betaina
Bibliografia
Homocistinemia e ateroesclerose
A homocistenemia é um factor de risco da ateroesclerose
A homocisteina em excesso forma a sua tiolactona que reage com os aminoacidos livres das LDL provocando a sua agregação e endocitose pelos macrofagos
Provoca ainda oxidação dos lipidos e agregação das plaquetas
Hipermetioninemia
Bibliografia
Secundaria
Observa-se em doenças hepáticas na tirosinemia tipo I e na homocistinuria clássica
Pode observar-se na imaturidade transitória da metionina adenosiltransferase em recemnascidos alimentados com dietas ricas em proteínas
Primaria
Deficiencia da adenosina metiltransferase hepática
Pode haver desmielinização
Cistinuria
Doença autosomica recessiva da reabsorção tubular dos aminoacidos dibasicos cistina, ornitina, lisina e arginina
Foi descrito uma alteração semelhante na mucosa intestinal mas não tem consequência porque estes aminoácidos são sintetizados no organismo
A cistina é relativamente insolúvel, podendo nos homozigotos, precipitar e formar cálculos renais
Bibliografia
Cistinose
É uma doença muito rara mas de grande gravidade
Há deposito de cistina em muitos órgãos e tecidos
A lesão tubular renal produzida pela cistina pode causar a doença de Fanconi
A morte é precoce
Bibliografia
CAPITULO 23
FENILALANINA E TIROSINA
Bibliografia
Transformação da fenilalanina em tirosina
É a via normal do metabolismo da fenilalanina.
Esta transformação faz-se pela acção da fenilalanina-hidrolase.
A fenillalanina hidrolase tem como coenzima a biopterina, que é uma biopteridina
As biopterinas têm grande semelhança estrutural com as flavinas e podem participar nas oxidações biológicas.
A forma activa da biopterina é a 5,6,7,8 tetrahidropterina que se forma a partir da 7,8-dihidropterina. Esta transformação é catalizada pela dihidropterina redutase, NADH dependente
Este conjunto de reacções é conhecido como NIH shift por ter sido caracterizado por cientistas do NIH
Catabolismo da tirosina
Transformação em ácido p-hidroxifenilpiruvico pela acção da tirosina transaminase.
Formação de ácido homogentísico pela acção da p-hidroxifenilpiruvato dioxigenase, sendo o oxigénio fornecido pelo oxigénio molecular.
O enzima tem um Fe++ que forma um complexo com o oxigénio molecular.
A homogentisico-1,2-dioxigenase catalisa a formação do ácido maleilacetico.
A maleilacetoacetato-isomerase catalisa a isomerização em ácido fumarilacetico
http://en.wikipedia.org/wiki/Tyrosine
Síntese de outras substancias
A tirosina é necessária para a síntese das hormonas tiroideias, da alanina e nor-adrenalina e das melaninas
Capitulo 24
PATOLOGIA DA FENILALANINA E TIROSINA
Alcaptonuria
Bibliografia
O acido homogentisico acumula-se nos tecidos e no sangue e depois passa para a urina, dando-lhe uma cor escura
A oxidação e polimerização deste acido produz um pigmento, a alcaptona
A alcaptona deposita-se nas cartilagens dando-lhes uma cor ocre, donde o nome ocronose
Não há tratamento efectivo
Tirosinemia
Bibliografia
Tirosinemia tipo I
Bibliografia
Descrição
É a deficiência em fumaril-acetato hidrólase
A acumulação de maleilacetato e fumarilacetato que são agentes alquilantes, provocam alquilação de DNA
Observa-se insuficiência hepatica e renal, raquitismo e polineuropatia
Tratamento
Nalguns doentes obtêm-se bons resultados com dietas pobres em tirosina e fenilalanina
Na maior parte dos casos trata-se com um inibidor da hidroxifenilpiruvato dioxigenase
Tirosinemia tipo II
Bibliografia
Não se faz a transaminação da tirosina em ácido p-hidroxifenilpirúvico devido à deficiência em tirosina aminotransferase
Atraso mental
Responde bem a dietas pobres em tirosina e fenilalanina
Albinismo
Bibliografia
Falta a tirosinase nos melanocitos, não se formando melanina
A pigmentação da pele, cabelos e íris é reduzida
A fraca pigmentação da íris causa fotosensibilidade
A fraca pigmentação da pele está associada com uma maior incidência do cancro da pele
A tirosinase envolvida na síntese das catecolaminas é um isoenzima diferente e não é afectada pelo gene do albinismo
Oligofrenia fenilpiruvica
É o erro mais frequente
Bibliografia
Falta de tirosina-oxidase
A fenilalanina não se transforma em tirosina, em geral por falta da tirosina-oxidase.
A fenilalanina converter-se-á alternativamente em ácido fenilpiruvico pela acção de uma transaminase.
Falta de formação de tetrahidropteridina
Conceito
1 a 2% dos doentes com hiperfenilalaninemia não sintetizam a tetrahidropteridina(BH4)
Estes doentes têm os mesmos sinais e por isso muitas vezes são diagnosticados como deficientes em tiroxina-oxidase
Todavia nestes doentes os sintomas mantêm-se após a supressão da fenilalanina na alimentação
Acção da BH4
A BH4 é também coenzima da triptofana-hidroxilase, necessária para a síntese da dopamina e da serotoni e também do enzima que catalisa a produção do acido nítrico a partir da arginina.
Defeitos enzimáticos
A BH4 é sintetisada a partir da GTP
Descreveram-se quatro deficiências enzimáticas nesta via
Rastreio
A fenilcetonuria afecta 1 em cada 10.000 crianças.
No nascimento não surgem sinais mas eles surgem precocemente caminhando rapidamente para uma oligofrenia grave.
Por esta razão deve-se fazer o seu rastreio em todos os recemnascidos
Fenilcetonuria nas grávidas
As gravidas com hiperfenilalaninemia correm um risco grave de ter filhos com oligofrenia fenilpiruvica
Devem fazer dieta para manter a fenilalanina abaixo de 6mg%
Tratamento
Correcção da hiperfenilalaninemia
Devem-se administrar alimentos pobres ou isentos em fenilalanina
A dieta deve ser iniciada imediatamente após o diagnostico
A dieta é obrigatória para valores acima de 6mg%
Como a fenilalanina é um aminoácido essencial, a dieta deve ser monitorizadas para os valores se manterem dentro do normal (2-6 mg%)
Administração de BH4
A administração de BH4 em doentes com defiociencia da tiroxina-oxidase pode ser útil
Nos doentes com deficiência em BH4 a administração de BH4 é obrigatória
Os deficientes em GTP ciclohidrolase respondem com doses menores (5-10 mg/kg/dia) que os deficientes em dihidropteridina redutase\(20 mg/kg/dia)
Administração de neurotransmissores e acido folico
Nos deficientes em BH4 recomenda-se a administração de dopamina e serotonina mesmo que o BH4 normaliza os teores em serotonina pois que o BH4 não penetra facilmente o tecido cerebral
A suplementação em acido folico está recomendada na deficiência em dihidropteridina redutase
Deficiência da BH4 com fenilalanina normal
É muito rara
Deve-se à deficiência em GTP ciclohidrolase
Manifesta-se por distonias musculares e sinais de Parkinson
Trata-se com DOPA associada ao inibidor proteico da dopa-descarboxilase
Capitulo 25
TRIPTOFANA
É um aminoácido essencial.
Participa na síntese de compostos de interesse biológico como a serotonina e a nicotinamida
Bibliografia
Síntese da serotonina , nicotinamida e melatonina
Serotonina
A serotonina é a 5-hidroxitriptamina
A triptofana é hidroxilada em hidroxitriptofana pela triptofana hidroxilase
A DOPA descarboxilase descarboxila a hidroxitriptofana em serotonina
É eliminada pela urina como acido 5-hidroxiindolacetico
A serotonina é sintetisada nas células cromafins
Nicotinamida
As primeiras etapas do catabolismo da triptofana são comuns à síntese da nicotinamida
A triptofana pirrolase cinde na presença de oxigénio o núcleo da triptofana
formando formilquinurenina
Esta ao perder a alanina origina a quinurenina pela acção da quinurenina formilase
A quinurenina pode transaminar-se e ciclizar-se em ácido quinurénico ou oxigenar-se em hidroxiquinurenina que por desaminação origina o ácido xanturénico.
Muitos das enzimas intervindo nestas reacções necessitam de vitamina B6 e por esta razão na deficiência nesta vitamina, aparecem aumentados na urina alguns metabólitos.
Nomeadamente o ácido xanturénico, a quinurenina e a hidroxiquinurenina, têm aumento particularmente notável após uma sobrecarga em triptofana.
Em seguida a hidroxiquinurenina pela acção da quinureninase perde a alanina para dar ácido β3-hidroxiantranalinico que se transformará em nicotinamina
A hidroxiquinurenina não metabolisada em nicotinamida transforma-se em ácido picolinico que, após uma série de transformações originará o acetoacetilCoA
Catabolismo pelas bactérias intestinais
No intestino as bactérias intestinais removem o acido piruvico formando indol
O indol é eliminado pela urina conjugado com o acido sulfúrico ou o acido glicuronico
Nas fezes é eliminado o seu derivado natural, o escatol
CAPITULO 26
PATOLOGIA DA TRIPTOFANA
Bibliografia
Doença de Hartnup
Bibliografia
Absorção reduzida e excreção aumentada de triptofana, devido a um defeito de transporte dos aminoácidos neutros
Como consequência, a síntese de nicotinamida diminui
A manifestação clínica mais importante é a fotosensibilidade cutanea
Se o aporte alimentar de nicotinamida for reduzido haverá sinais de pelagra
Trata-se com a administração de nicotinamida ou acido nicotínico e uma alimentação rica em proteínas
Esquizofrenia
Alguns autores propuseram considerar a esquizofrenia como uma doença do metabolismo da triptofana e por esta razão aconselham para o seu tratamento dietas pobres em triptofana
Pelagra
A vitamina P.P . é a única vitamina que é sintetizada no organismo , mas a síntese tem que ser complementada pela alimentação. Quando a via sintética é inibida por certos tóxicos como as aflatoxinas surgr a pelagra
Outras doenças
Descreveram-se acumulação de plaquetas em depressões e no cérebro na porfiria intermitentev aguda
Capitulo 29
DIGESTÃO DAS PROTEINAS
Classificação dos enzimas proteolíticos
Enzimas intracelulares
- Encontram-se nos lisossomas
- Não intervêm na digestão
- São responsáveis pelos fenómenos de autolise post-mortem
Enzimas extracelulares
- Encontram-se nos sucos digestivos
- Dividem-se em exo e endopeptídases
Endopeptidases
- Hidrolisam ligações péptido situadas no interior da cadeia
- Existem como pró-enzimas
Pepsina´
Bibliografia
http://www.sigmaaldrich.com/life-science/metabolomics/enzyme-explorer/analytical-enzymes/pepsin.html
Activação
· Existe sob uma forma inactiva, o pepsinogenio
· Em meio acido o pepsinogenio cinde-se num péptido com cinco aminoácidos e o complexo pepsina-inibidor
· Em meio mais acido, a pepsina liberta-se do inibidor
· Em meio alcalino esta reacção iinverte-se
· A pepsina formada também hidrolisa o pepsinogenio – autocatálise
http://www.sigmaaldrich.com/life-science/metabolomics/enzyme-explorer/analytical-enzymes/pepsin.html
Ponto de acção
- Actua sobre ligações péptido em que a amina pertence a um grupo aromático( fenilalanina ou tirosina)
- A uma velocidade menor cinde também ligações leucina-valina e leucina-acido glutâmico
Tripsina
Bibliografia
- Resulta da activação do tripsinogenio, sintetizado no pâncreas
- A activação do tripsinogenio é processada pela enterocinase na presença de cálcio,libertando-se tripsina e um hexapeptido
- A tripsina formada activa o tripsinogenio por autocatalise
- Actua sobre ligações péptido em que a arginina e a lisina participam pelos seus carboxilos
- O soro contem um inactivador da tripsina
Quimotripsina
Bibliografia
· É activada pelo tripsinogénio
· A sua especificidade é menor
· Hidroliza ligações péptido em que estejam implicadas pelo carboxilo a tirosina, fenilalanina, triptofana, metionina ou leucina.
· Hidroliza ligações péptido em que estejam implicadas pelo carboxilo a tirosina, fenilalanina, triptofana, metionina ou leucina.
Exopeptidases
- Hidrolisam ligações péptido situadas no topo da cadeia
Carboxipeptidases
· Atacam a ligação péptido mais próxima do carboxilo terminal
· A carboxipeptidase A actua sobre aminoácidos aromáticos, sendo a actividade máxima com a fenilalanina
· A carboxipeptidase B actua sobre aminoácidos básicos
· Não actuam sobre a prolina ou a hidroxiprolina
· Existem como pró-enzimas, activados pela tripsina
Aminopeptidases
- Actuam sobre a extremidade próxima da amina terminal
Dipeptidases
- Actuam sobre dipeptidos
- Necessitam de iões metálicos bivalentes
- Conhecem-se:
Glicil-glicina dipeptidase
Prolinase
- Só actua se a amina terminal pertencer à prolina
Prolidase
- Só actua se o carboxilo terminal pertencer à prolin
Absorção
- As proteínas e os péptidos provenientes de hidrolises parciais são degradados em aminoácidos pelas proteases pancreáticas e pelos enzimas das células intestinais e em seguida absorvidos por transporte activo
Patologia da digestão dos protidos
Redução das áreas absortivas
Doença celíaca
Causa uma atrofia dos vilos, em especial no intestino delgado proximal, com a consequente deficiência de absorção
Em geral desaparece com a supressão do glúten na alimentação
Aparece usualmente no primeiro ano de vida com dificuldades no crescimento e diarreia
Causa uma atrofia dos vilos, em especial no intestino delgado proximal, com a consequente deficiência de absorção
Sprue
- A atrofia dos vilos não responde ao glúten
- Poderá ter uma causa bacteriana porque às vezes esta situação responde a antibióticos de largo espectro
- O folato parece ser útil
Cirurgia
- Grandes ressecções do intestino delgado reduzem grandemente a área absortiva
Inflamação
- A inflamação do intestino como na doença de Crohn dificultam a absorção intestinal
Gastrectomia
- Não se efectua no estômago a mistura dos alimentos com pepsina e acido clorídrico
- Haverá uma actividade enzimática diminuída no intestino
- Há também um aumento de transito no intestino
Pâncreas
Fibrose quistica do pâncreas
- É uma doença autossomica recessiva do transporte dos cloretos, afectando as secreções das glândulas exocrinas
- Não são sintetizados os enzimas pancreáticos
- Digestão proteica deficiente, levando a sindromas de má absorção
Ablacção da cabeça do pâncreas
- 50% das proteinas ingeridas são eliminadas pelas fezes
Pancreatite aguda hemorrágica
- Necrose das células pancreáticas associada com a <libertação de enzimas para o espaço retroperitoneal e corrente sanguínea
- A existência de suco pancreático na cavidade abdominal provoca dor abdominal intensa e shock
- A tripsina libertada e activada pela necrose do pâncreas provoca a autodigestão da cabeça do pâncreas
- Cria-se assim um ciclo vicioso:quanto mais é destruído o pâncreas, mais enzimas se liberta
Pancreatite crónica
- É mais frequente em alcoólicos
- Pode haver intolerância à glicose pela redução do numero de ilhéus de Langerhans
- Há uma diminuição da actividade dos enzimas pancreáticos
Capitulo 30
METABOLISMO DA HEMOGLOBINA
Estrutura
A hemoglobina é um pigmento tetrapirrolico
A introdução de alguns grupos substituintes nas porfinas forma as porfirinas
Porfirinas
A combinação desta com o ferro forma o heme
A proteína da hemoglobina é a globina.
É composta por quatro subunidades contendo hemes – duas cadeias a e duas cadeias b
A sequência de aminoácidos de cada cadeia é determinada geneticamente, levando qualquer mutação do gene a uma anomalia da estrutura.
Em cada subunidade, tal como na mioglobina, existe uma bolsa para receber o heme.
Este une-se pelo seu átomo de ferro que por ter seis valências, dispõe de duas valências livres para lá das que utilizou para se combinar com os pirrois.
Na cadeia b uma destas valências liga-se à histidina 92, proximal, e a outra à histidina 63 distal através de uma molécula de água .
Na cadeia alfa, as histidinas envolvidas são as 87 e 58.
Diversidade estrutural
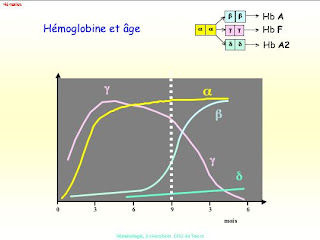
No decorrer da vida humana formam-se diferentes formas de hemoglobina.
Na vida adulta a forma quase exclusiva é a hemoglobina a2b2.
Todavia desde a concepção até aos primeiros tipos de vida aparecem e desaparecem várias formas de hemoglobina.
A hemoglobina fetal contém duas cadeias a e duas cadeias que irão desaparecer, as cadeias d – é portanto a2d2.
No embrião encontram-se as cadeias e e z.
No adulto 2% da hemoglobiina é constituída pela hemoglobina A2 de constituição a2d2(
cortesia do prof Christian Binet
Síntese
O heme é sintetizado por uma série de reacções, umas nas mitocôndrias, outras no citossol
Cortesia de Joyce Diwan
A primeira reacção é a síntese do acido deltaaminolevulínico pela reacção do succinil-CoA com a glicina, catalisada pela deltaminolevulínico sintetase ou ALA-sintetase
A ALA sintetase encontra-se nas mitocôndrias, enquanto que o sucinil CÔA é sintetizado no citoplasma, devendo portanto ser transportado para as mitocôndrias
O ALA é transportado para o citoplasma para se condensar com outro ALA para dar o porfobilinogénio
O porfobilinogénio irá sofrer uma série de transformações para originar a protoporfirina IX
A ferroquelatase irá introduzir o ferro na protoporfirina IX para originar o heme
Regulação
O enzima chave é a ALA sintetase
O seu principal inibidor alostérico é o heme
Os esteroides e alguns medicamentos podem estimular este enzima
Transporte do oxigénio
Quando o sangue pobre em oxigénio passa pelos pulmões, este recebe o oxigénio que se difundiu pelos pulmões
Nos eritrocitos o oxigénio, oxigena mas não oxida a hemoglobina ( o ferro continua bivalente) devido a uma alteração da conformação da hemoglobina, que se transforma em oxi-hemoglobina
Nos capilares dos tecidos passa-se o processo inverso – a oxihemoglobina cede o oxigénio aos tecidos e transforma-se em desoxihemoglobina
Estes fenómenos passam-se porque a desoxihemoglobina tem maior afinidade para o O2 ( efeito Haldane) e H+ (efeito Bohr)
| |
| |
Figure 7
This is a schematic diagram of the flow of blood through the circulatory system, showing the sites of O2/CO2 exchange in the body.
Note: The components of this diagram are not drawn to scale.
| |
cortesia de R.Frey
Transporte do anidrido carbónico
O CO2 entra e sai da célula difundindo-se através de canais transmembranarios
Dentro do glóbulo metade combina-.se com a hemoglobina dando carbohemoglobina.
A outra metade converte-se em bicarbonato e H+ pela acção da anidrase carbónica
O bicarbonato difunde-se para o plasma
O H+ combina-se com a hemoglobina que funciona como tampão
Cortesia de Chemical Society
Ciclo de Rapaport-Luebring ou ciclo do fosfoglicerato
No eritrocito encontra-se o ácido 2,3– bisfosfoglicérico
As suas cargas negativas unem-se às cadeias de carga positiva da hemoglobina facilitando a expulsão de oxigénio para os tecidos
Forma-se a partir do acido 1,3-bisfosfoglicérico pelo ciclo de Rapaport-Luebring
Aumenta em populações vivendo em altas altitudes devido à falta de oxigénio, em situações de anoxia,e em doenças crónicas em que haja má distribuição de oxigénio e em anemias graves
BIBLIOGRAFIA
Ilustrações- hemoglobina
Catabolismo do heme
Ciclo de Rapoport- Luebering
Heme
Ilustrações – estrutura do heme
Porfirinas
Síntese do heme
Capítulo 31
PATOLOGIA DOS ERITROCITOS
Anemia
É a redução da capacidade do sangue em transportar oxigénio, devendo-se a diminuição dos eritrocitos, baixo teor em hemoglobina e hemoglobinas anormais
Diminuição dos eritrocitos
Anemias hemorrágicas, por perda de sangue
Anemias hemolíticas por destruição precoce dos eritrocitos
Anemias aplasticas por diminuição da eritropoiese
Baixo teor em hemoglobina
Anemia por perda de ferro ou microcitica. Chama-se microcitica por os glóbulos serem pequenos e pálidos
Anemia dos atletas
Em períodos de treino intensivo, o volume sanguíneo pode aumentar até 15%, diminuindo a quantidade de eritrocitos por unidade de volume
Anemia perniciosa por falta de vitamina B12
Hemoglobinas anormais
Conceito
Desde que em 1949 PAULING e ITANO descreveram que a drepanocitose era devida à existência de uma hemoglobina anormal , a hemoglobina S, nasceu pela primeira vez a noção que a doença poderia ser devida à alteração da molécula
Abriu-se assim um novo domínio de estudo, a patologia molecular
A partir daí descreveram-se inúmeras hemoglobinas anormais.
Classificação
Conforme a natureza da anormalidade podemos classificà-las em:
- Alterações da estrutura primária
- Diferente combinação das cadeias
- Diferente repartição das variedades de hemoglobina
Alterações da estrutura primária
As mais frequentes são a hemoglobina S e as hemoglobinas M
Hemoglobina S
Na hemoglobina S houve uma substituição em b6 do ácido glutâmico pela valina.
Esta nova valina fica muito próxima da valina em 1 o que leva estas duas valinas a aproximarem-se pelas forças de van der Waals e a ciclizar a extremidade da cadeia, ciclização estabilisada por uma ligação ponte de hidrogénio entre o azoto da treonina 4 e o carboxilo da valina 1.
Esta ciclização explicaria a formação de glóbulos em foice (falciformação) e a sua agregação com outras moléculas de globina
Hemoglobinas M
.Parte da hemoglobina oxida-se em meta-hemoglobina(ferro trivalente) que não transporta oxigénio mas em condições normais, a meta-hemoglonina redutase reduz de novo a meta-hemoglobina
As hemoglobinas M manifestam-se pela formação de metahemoglobinas anormais e que persistem porque não se reduzem em hemoglobina pela acção dos sistemas redutores existentes no organismo o que as impede de ceder oxigénio aos tecidos.
Devem-se à mutação de um aminoácido numa zona vizinha à bolsa onde se anicha o heme.
As mais comuns resultam da substituição de uma histidina(a58, a87 ou b63) pela tirosina ou da b- valina 67 pelo acido glutâmico.
Diferente combinação de cadeias
Ausência de cadeias
Nalgumas destas hemoglobinas há a ausência de cadeias A.
Nesta situação o seu lugar é ocupado por outra hemoglobina, no adulto pela b( hemoglobina b4 ou hemoglobina H)e no feto pela g (hemoglobina g4 ou hemoglobina de Bart).
Cadeia mista
Nas hemoglobinas de cadeia mista há um crossing-over entre genes responsáveis pela síntese de cadeias diferentes.
Na hemoglobina Lepore há duas cadeias a ligadas a duas cadeias anormais formadas pela reunião da metade N-terminal da d com a metade C-terminal da b.
Porfirias
Deficiência de um dos enzimas da síntese das porfirinas.
Como levam a uma síntese diminuída do heme deixa de haver a inibição alosterica da ALA-sintetase
Resulta a acumulação de precursores das porfirinas (ALA, PBG) e porfirinas
Quando há aumento de precursores, as manifestações são neurológicas
Quando as porfirinas se acumulam o principal sinal é a fotosensibilidade – as porfirinas absorvem luz e ficam excitadas, induzindo a formação de radicais livres.
Hemoglobina glicosilada
A hemoglobina A1 reage espontaneamente com a glicose para formar a hemoglobina glicosilada ou hemoglobina A1.
Normalmente a concentração desta hemoglobina é muito baixa mas na diabetes pode atingir 12% da hemoglobina total ou mais.
Poliglobulia ou policitemia
Há aumento do número de eritrocitos
Aumenta a viscosidade do sangue e diminui a velocidade da circulação
A policitemia primária ou doença de Vaquez deve-se a um cancro da medula
As policitemias secundarias podem resultar de numa adaptação à falta de oxigénio ou à produção excessiva de eritropoietina
BIBLIOGRAFIA
Destruição dos eritrocitos
Os eritrocitos têm uma vida útil de 120 dias, sendo destruídos nos pequenos vasos e no baço
Os macrofagos fagocitam os eritrocitos, fragmentam-nos, o heme separa-se da globina e o ferro é recuperado
O restante do heme é degradado em bilirrubina
A bilirubina é degradada em estercobilina,em urobilina, incolor, eliminada pela urina e estercobilina, corada, que dá cor às fezes
HEMOGLOBINA
Globina
Ferro---- Transferrina
Biliverdina
H+ NADPH + H+
Biliverdina redutase
Bilirubina
Acido glicuronico
Bilirubina conjugada
Capitulo 32
SINTESE DOS NUCLEOTIDOS COM PURINAS
Precursores do núcleo purico
As purinas formam-se a partir dos seguintes precursores
- Glicocola – C4,C5,C7
- Formil-FH4 – C2,C3
- Glutamina – N3,N9
- Acido aspartico – N1
- CO2 – C1
Síntese do IMP
É o primeiro nucleotido a ser formado
Os outros formam-se a partir dele
Formação do fosforibosilpirofosfato(PRPP)
È a forma activa da ribose
A PRPP sintetase catalisa a combinação da fosforibose com o ATP
Formação do ribotido de glicinamida
A glutamina cede a amida ao PRPP para formar a fosforibisilamina. O enzima é a PRPP amidotransferase
A fosforibosilamina reage com a glicina na presença de ATP para dar o ribotido de glicinamida O enzima é a fosforibosilglicinamida sintetase
Transferencia de um carbono
O formil-FH4 transfere um carbono, formando-se o ribotido de formilglicinamida O enzima é a formilglicinamida formiltransferase
Amidinação
A glutamina cede uma amida para formar o ribotido de formilglicinamidina
É necessário ATP
Formilação em ribotido de formilglicinamida
A formilação é feita pelo formil FH4
Ciclização
O ciclo fecha-se formando-ser o ribotido de 5-aminoimidazol
O enzima é a 5-imidazol sintetase
E necessário ATP
Visão global destas etapas
Ribose
PRP NH2
Glutamina
Fosforibosilamina
Glicina
Ribotido da glicinamida
FH4
Ribotido da formilglicinamida
NH2 Glutamina
x
Ribotido da formilglinamidina
Encerramento do ciclo
Ribotido do amino-imidazol
Carboxilação
O 5-aminoimidazol é carboxilado no acido 5-aminoimidazolcarboxilico
Amidação
O ribotido amida-se por combinação com o acido aspartico para se formar uma carboximida, o ribotido da 5-amino-4-imidazol-sucino-carboximida
Perda do acido fumarico
A carboxiamida perde o acido fumarico para dar o ribotido da 5- aminoimidazolcarboxiamida
Formação do IMP
Forma-se o 5-formamidoimidazol-4-carboxiamida-ribonucleotodo pela reacção com o formil-FH4
Este desidrata-se em seguida formando o IMP
Síntese do AMP
Formação de acido adenilosuccinico
O IMP combina-se com o acido aspartico para dar o acido adenilosuccinico
O enzima e a adenilosuccinatosintetase
A energia para a síntese é fornecida pela hidrolise do GTP
Formação do AMP
- A adenilosuccinato é hidrolisado em acido fumarico e AMP
- O enzima é a adenilosuccinatoliase
Formação do XMP
O IMP é hidrolisado em XMP pela IMP deidrogenase
Formação do GMP
Forma-se pela transferência de uma amida da glutamina para o XMP
O enzima é a XMP transferase
Ciclo dos nucleotidos da purina
Este ciclo tem um papel importante no musculo em exercicio
A geração de acido fumarico fornece ao musculo o único substracto anaplerotico para o ciclo de Krebs
No decorrer do exercicio as proteinas musculares podem ser utilizadas para fornecer aspartato
Formação dos nucleotidotrifosfatos
Resultam da fosforilação dos mucleotido monofosfatos pelo ATP pela acção de
transfosforilases
Utilização das purinas livres
As bases puricas resultantes do metabolismo dos nucleotidos com purinas podem ser recicladas para a síntese de novo dos nucleotidos, por combinação com o PRPP
A adenina origina o AMP combinando-se com o PRPP pela acção da adenina fosforibosiltransferase e a adenosina combinando-se com o ATP pela acção da adenosina cinase
A hipoxantina e a guanina combinam-se com o PRPP para dar respectivamente IMP e GMP pela nacção da hipoxantina-guanina transferase
Regulação da síntese
A PRPP sintetase é inibida pelos nucleotidos com purina, em especial o AMP e o GMP por alteração de conformação
A amidotransferase é inibida num sitio alosterico pelos adenina nucleotidos (AMP, ADP, ATP) e noutro sitio pelos guanina nucleotidos
Um excesso de ATP aumenta a síntese de AMP e a um aumento de GTP e AMP
Capitulo 33
SINTESE DOS NUCLEOTIDOS PIRIMIDICOS
Origem dos carbonos
Os carbonos provêm do acido aspartico, glutamina e anidrido carbónico
Síntese do UMP
Formação do carbamil-fosfato
O carbamilfosfato forma-se pela combinação do bicarbonato com a glutamina pela acção duma carbamilfosfato sintetase citoplasmica, ao contrario do formado na síntese da ureia em que o enzima é mitocondrial
Sintese do carbamilaspartato
Forma-se por combinação do carbamilfosfato com o aspartato pela acção da aspartato transcarbamilase
Formação do acido orotico
O carbamilfosfato desidrata-se em acido dihidroorotico que por sua vez cede hidrogénio para o NAD para originar o acido orotico.
Formação do UMP
O acido orotico combina-se com o fosforibosil pirofosfato dando acido orotidilico que em seguida origina o UMP por descarboxilação
Síntese das CMP e TMP
O UMP transforma-se em UTP que aminado pela glutamina originando o CTP. Este forma o dUMP que em seguida se metila em TMP
Para formar o CMP o CTP sobre duas desfosforilações
Regulação
Carbamilfosfato sintetase
É a principal via reguladora
É inibida pela UTP, produto final da reacção e activada pelo PRPP
OMP descarboxilase
A UMP compete com o OMP na OMP-descarboxilase
Capitulo 34
CATABOLISMO DAS BASES PURICAS E PIRIMIDICAS
Bibliografia
Bases puricas
Desaminação da adenina em hipoxantina e da guanina em xantina pela acção das respectivas desaminases
A hipoxantina é oxidada em xantina pela hipoxantina-oxidase
A xantina-oxidase oxida a xantina em acido úrico
Bases pirimidicas
O catabolismo das pirimidinas é complexo
Os produtos finais da degradação são a beta-alanina para o uracilo e o acido beta-amino butirico para a timina
Capitulo 35
PATOLOGIA DAS PURINAS
Xantinuria
Causas
Deficiência em xantina-oxidase
Sintomas
Xantina elevada
Acido úrico baixo
Cálculos renais de xantina
Depósitos cristalinos nos rins e músculos esqueléticos
Tratamento
Restrição de alimentos ricos em purinas
Ingestão de líquidos
Alopurinol – Bloqueia a conversão da hipoxantina em xantina, esta ultima menos solúvel
Hiperuricemia
Causas sistémicas
Clearance renal de uratos diminuída, como é o caso do tratamento prolongado com diuréticos
Aumento da sintese de purinas por um turnover aumentado de nucleoproteinas, que se passa nalgumas situações hematológicas ( linfomas, leucemias, anemia hemolítica)
Ingestão aumentada de alimentos ricos em purinas, em especial se forem acompanhados de bebidas alcoólicas
O álcool induz o catabolismo dos nucleotidos no fígado aumentando a secreção de acido láctico que bloqueia a secreção de uratos pelo rim
Causas genéticas
Deficiência em hipoxantina-guanina-fosforibosil-transferase
Hiperactividade a PRPP sintetase
Sintomas
O plasma fica saturado em acido urino concentrações superiores a 7 mg%
Os uratos são solúveis até 4mg%
A partir destes limites pode cristalizar e depositar-se em artilagens, tendões e ligamentos
Quando os cristais se agregam formam tofos visíveis aos R.X.
Se a urina é acida pode formar cálculos renais
Há casos de hiperuricemia sem gota
Tratamento
Alopurinol, análogo estrutural da xantina, que inibe a xantina-oxidase
Os anti-inflamatorios não esteroides são eficazes no tratamento da fase aguda da gota, mas não baixam a hiperuricemia
Sindroma de Lesch-Nyhan
Causas
Perda do gene da HRPT
Doença ligada ao sexo pois o gene encontra-se no cromossoma X
Sintomas
Gota severa
Malfunção grave do sistema nervoso
Tendência para a auto-mutilação
Tratamento
Prevenção da insuficiência renal
Alopurinol
Esforços para reduzir a automutilação
SCID( Doença de Imunodeficiência severa combinada)
Causas
Deficiência em adenosina desaminase
Esta deficiência leva à destruição dos linfocitos B e T
Na falta deste enzima, a desoxiadenosina é fosforilada provocando teores elevados de dATP, inibidor da nucleotido redutase com a consequente inibição da síntese do DNA
Sintomas
Imunodeficiência
Tratamento
Transfusões
Transplante da medula
Substituição enzimática
Terapia genica
Glicogenose tipo I
A deficiência em glicose-6-fosfatase leva a uma síntese aumentada de pentose-fosfatos
Há assim mais ribose para formar PRPP
CAPITULO 36
Formação dos desoxiribonucleotidos
A ribonucleotido- redutase catalisa a formação de desoxiribonucleotidos a partir de nucleotidos
O dador de hidrogénio para a redução da ribose é tioredoxina reduzida
A tioredoxina é uma proteína com enxofre tendo SH quando reduzida e S-S quando oxidada
A tioredoxina oxidada é reduzida pelo NADPH pela acção da tiopredoxina redutase
A tioredoxina reduzida cede os seus H para formar os desoxiribonucleotidos
Regulação
O dATP e dTTP são efectores alostericos positivos
O ATP acelera a redução dos ATP e CDP
O GTP acelera a redução do ADP e GDP
Capitulo 37
SINTESE DE OUTROS NUCLEOTIDOS
NAD e NADP
Condensação do nicotinato ou da nicotinamida com o PRPP
Forma-ser o nicotinamida ribonucleotido pela acção da nicotinato ou nicotinamida fosfotransferase
O nicotinamida mononucleotido(NMP) pode formar-se também pelo metabolismo da triptofana,oque permite formar o NAD e NADP mesmo numa alimentação pobre em nicotinamida e acido nicotínico
O mononucleotido combina-se com o ATP pela acção da NAD pirofosforilase para da o NAD
A NAD cinase fosforila o NAD em NADP
FAD
A riboflanina é fosforilada pela flavocinase para dar ao FMN
Pela acção da FAD pirofosforilase o FMN liga-se com o AMP para dar o FAD
CoA
O acido pantotenico é fosforilado pelo ATP em 4-fosfopantenato pela pantenato cinase
Este combina-se com a cisteina para dar fosfopantenilcisteina, reacção catalisada pela fosfopantenocisteina sintetase
Esta descarboxila-se em 4-fosfopantetina pela acção da fostopantotenoil descarboxilase
Esta liga-se ao AMP para dar a defosfoCoA pela acção da defosfoCoA pirofosforilase
A defosfoCoA cinase fosforila o grupo 3’-OH da adenosina para dar o CoA
Capitulo 38
CATABOLISMO DOS ACIDOS NUCLEICOS E NUCLEOTIDOS
Ácidos nucleicos
As nucleoproteinas são cindidas pelas proteases em proteínas e ácidos nucleicos
Os ácidos nucleicos são cindidos por endonucleases e exonucleases
Endonucleases
Desoxiribonucleases do pâncreas
Cindem ligações 3’-5’ para produzir grandes nucleotidos 5’-fosfoterminais
Desoxiribonucleases do baço
Cindem ligações entre o fosfato e o carbono 5’ produzindo nucleotidos 3’-fosfoterminais
Ribonuclease
Existem no intestino, fígado e pâncreas
Hidrolisam ligações fosfato ligadas ao 5’ produzindo nucleotidos 3’-fosfoterminais
Requerem uma pirimidina no nucleotido 3’-fosfoterminal
Exonucleases
Cindem a ligação fosfodiester na extremidade da cadeia polinucleotidica
A mais importante é aa exonuclease do baço que liberta nucleotidos -3-fosfato
´Catabolismo dos nucleotidos e nucleósidos
Os nucleotidos são desfosforilados por nucleotidases
Os produtos finais são a pentose-fosfato e a respectiva base










































































Sem comentários:
Enviar um comentário