Digesrão e transporte dos glucidos
Patologia da digestãoa e transporte dos glucidos
Glicolise
Destinos do acido piruvico
Produção de energia do musculo
Patologia da glicolise
Glicogenese
Glicogenolise
Glicogenoses
Neoglicogenese
Regulação do metabolismo dos glucidos
Patologia da neoglicogenese
Regulaçao da glicemia
Diabetes
Sindroma plurimetabolico
Ciclo de Dickens-Horecker
Patologia do ciclo de Dickens- Horecker
Metabolismo das hexoses e da lactose
Patologia do metabolismo das oses
Metabolismo do acido glicuronico
Metabolismo dos derivados das
Patologia da digestãoa e transporte dos glucidos
Glicolise
Destinos do acido piruvico
Produção de energia do musculo
Patologia da glicolise
Glicogenese
Glicogenolise
Glicogenoses
Neoglicogenese
Regulação do metabolismo dos glucidos
Patologia da neoglicogenese
Regulaçao da glicemia
Diabetes
Sindroma plurimetabolico
Ciclo de Dickens-Horecker
Patologia do ciclo de Dickens- Horecker
Metabolismo das hexoses e da lactose
Patologia do metabolismo das oses
Metabolismo do acido glicuronico
Metabolismo dos derivados das
CAPITULO 1
DIGESTÃO E TRANSPORTE DOS GLUCIDOS
Amilases
Amilase salivar
Encontra-se na saliva como ptialina
A digestão do amido começa na boca
A mucina salivar é importante para a sua lubrificação e dispersão
A amilase salivar hidrolisa ao acaso ligações internas a-1,4 – é portanto uma endoglicosidase
Quando o bolo alimentar chega ao estomago, a amilase é desnaturada, deixando de actuar, excepto uma pequena fracção contida no interior do bolo alimentar
Amilase pancreática
O processo digestivo continua quando os alimentos chegam ao duodeno.
As secreções pancreática contêm bicarbonato e amilase
Os bicarbonatos neutralizam a acidez, permitindo a acção da amilase pancreática
Nesta fase formm-se diholosidos com ligações 1-4( maltose e isomaltose) e 1-6 (isomaltose) e oligosidos contendo até 8 residuos glicosilo alguns com ligações 1,6 (dextrinas-limite)2069
Glicosidases
A hidrolise dos diholosidos e das dextrinas limites faz-se através de glicosidases colocadas nas membranas das células em escova das vilosidades intestinais.
As glicosidades agruparam-se em quatro complexos diferentes:
Complexo sacarase-isomaltase
Hidrolisa a sacarose, maltose e isomaltose
Tem duas subunidades a sacarase , que hidrolisa a sacarose e a maltose e a isomaltase
Está mais concentrada no jejuno, diminuindo para as extremidades proximal e distal do intestino
Complexo glico-amilase
Actua sobre as dextrinas limite e é também uma maltase.
A sua actividade aumenta progressivamente ao longo do intestino, sendo máxima no ileon
Complexo beta-glicosidase( lactase)
Hidrolisa a lactose em glicose e galactose
A sua distribuição no intestino é igual à do complexo sacarase-isomaltase
Trealase
Hidrolisa o diholosido trealose
A trealose não é um componente essencial da alimentação pois encontra-se em insectos, algas e cogumelos.
Foram descritos sintomas graves num deficiente em trealase que ingeriu muitos cogumelos
Absorção e transporte dos glucidos
Glicose
A glicose é muito polar e não se difunde através dos fosfolipidos da membrana celular.
Cada oxidrilo da glicose forma pelo menos duas pontes de hidrogénio com moléculas de agua.
Este objectivos conseguem-se com proteínas de transporte, designadas por família GLUT
Há dois tipos de transporte -os dependentes do sódio, utilizando a bomba de sódio, e os de difusão facilitada, independentes do sódio.
Dependentes do sódio
São os transportadores GLUT 5 localizados no lado luminal das células absortivas intestinais.
Permitem concentrar glicose a partir do lume intestinal
Neste processo o transporte da glicose está associado ao transporte activo de sódio gerado pela bomba de sódio, embora a glicose seja captada por difusão facilitada.
A energia dará a captação do sódio é dada pela hidrolise do ATP, catalisada pela Na+K+ ATPase.
O sódio move-se para o sangue por troca com o potássio
Transporte independente do sódio
GLUT 1 e 3
Encontram-se em todas as células menos as do fígado e pâncreas.
São responsáveis pela captação básica de glicose, permitindo uma difusão lenta mas regular da glicose
GLUT 2
Encontram-se no fígado e células beta do pâncreas
Permitem a entrada de glicose para o fígado e células beta quando o GLUT 1 está saturado
GLUT4
Encontram-se nos adipocitos e nas células dos músculos esqueléticos
São regulados pela insulina
Quando este transportador está saturado a secreção de insulina aumenta
A insulina activa o gene GLUT 4
Capitulo 2
PATOLOGIA DA DIGESTÃO E TRANSPORTE DOS GLUCIDOS
Cólera
A exotoxina do vibrião da cólera inibe a formação do AMP cíclico, o que acarreta a diminuição da absorção de agua e sódio do lume pelas células intestinais
Acresce-se o aumento de cloro, catiões e agua no lume, pela acção da toxina sobre as criptas
Estes factos levam a uma diarreia intensa que pode atingir 1 l./hora com grande perda de solutos, o que acarreta uma desidratação intensa.
Como o transporte dependente de sódio não é afectado pela toxina, a administração oral de glicose e sódio aumenta a captação de glicose e sódio, acompanhada da de cloro e água, diminuindo assim a gravidade dos sintomas
Deficiência em lactase
Deficiência congénita em lactase
É muito rara
A lactose acumulada transforma-se em acido láctico provocando diarreias intensas e cólicas após a introdução de leite ou produtos lácteos
Deficiência em lactase associada à prematuridade
O enzima não é sintetizado na altura do nascimento mas passa a sê-lo após alguns dias
Deficiência do adulto
A maior parte é adquirida
Muitas alterações generalizadas do intestino podem produzir deficiências em dissacaridases pois estes enzimas estão colocados no bordo em escova das células intestinais.
Possivelmente acontece em indivíduos geneticamente predispostos
Tratamento
Nas crianças deverá ser prescrita uma alimentação sem leite. A dieta deverá evitar a falta de nutrientes essenciais
O adulto com esta deficiência tolera pequenas quantidades de leite e por isso deve conhecer os limites
O iogurte e o queijo são melhor tolerados devido à fermentação parcial da lactose
Deficiências em sacarase – isomaltase e em maltase
A deficiência congenita em sacarase-isomaltase é mais frequente que a da lactase
As deficiências adquiridas de sacarase-isomaltase e de maltase são muito raras
Os sintomas são semelhantes aos da insuficiência em lactase
Doença celiaca
Causas
Na gliconeogenese, a formação da glicose pode começar a partir da carboxilação do acido pirúvico
Causas
A mucosa do intestino delgado proximal é sensivel ao glúten alimentar
A doença não surge sem a ingestão previa de produtos com glúten
Normalmente surge entre os seis meses e 2 anos e constitui uma intolerância permanente ao glúten
O glúten encontra-se no trigo, centeio e cevada
Patogenese
A acção deve-se à gliadina que contem sequencias de aminoacidos repetidas que levam à sensibilização dos linfocitos da lamina própria
Há uma predisposição genética
A resposta imunitária desencadeia uma reacção inflamatória que leva à atrofia das vilosidades, hiperplasia das criptas e lesão do epitelio superficial do intestino delgado
A lesão é mais intensa no intestino delgado proximal e estende-se progressivamente para a parte distal
Este facto explica a variabilidade dos sintomas
Sintomas
O mais comum é a diarreia
10% das crianças têm atraso de crescimento sem diarreia
Anorexia e perda de peso são frequentes
Tratamento
Alimentação totalmente isenta de glúten durante toda a vida
Todos os produtos com trigo, centeio e cevada devem ser proscritos
Muitos alimentos processados têm glúten
Crise celíaca
Diarreia grave, perda de peso, hipocalcemia, hipoproteinemia
O tratamento pode incluir corticoides
Capitulo 3
GLICOLISE
Provem das palavras gregas glyko(doce) e lysis(desaparecimento)
É a transformação da glicose em ácido piruvico ou acido láctico em anaeróbios
É uma via citoplasmica
Nas leveduras é a via final da destruição da glicose
Nos animais, à glicolise segue-se a via aerobica, representada pelo ciclo de Krebs
Etapas
A animação permite uma boas compreensão da glicólise:
Formação da glicose-6- fosfato
A glicose para entrar na célula tem de se fosforilar em glicose-6-fosfato,pela acção da hexocinase
Isoenzimas da hexocinase
Na maior parte dos tecidos existem os isoenzimas I, II e III, muito sensíveis mas pouco específicos
No fígado é abundante o enzima IV ou glicocinase enzima especifico mas pouco sensível, o que lhe permite actuar sobre as altas concentrações de glicose que se observam após as refeições
As hexocinases são enzimas alostericos, regulados pelo produto da reacção, a glicose-6-fosfato
Formação da fructose-6-fosfato
É a conversão duma aldose numa cetose
http://www.dbio.uevora.pt/jaraujo/biocel/glicolise.htm
Formação da fructose – 1,6 – bisfosfato
É uma reacção irreversivei, necessitando de ATP
Criou-se um ponto fraco na molécula que irá facilitar a sua posterior cisão
Cisão da frutose-1,6- bis fosfato
A frutose 1-6 bisfosfato é cindida em duas triose-fosfato, o fosfogliceraldedo e a fosfodihidroxiacetona pela acção da aldolase
As duas triose fosfato isomerizam-se uma na outra pela triose-fosfato isomerase
Como o fosfogliceraldeido é a única triose a ser utilizada, a fosfodihidroxiacetona ir-se-á transformando em fosfogliceraldeido
Formação do gliceraldeido 1,3-bisfosfato
A triose fosfato deidrogenase desidrogena o gliceraldeido 1,3 – bisfosfato, associada a uma fosforilação, com a formação de uma ligação fosfato de forte potencial
O hidrogénio libertado é captado pelo NAD
Transformação em 3-fosfoglicerato
O fosfato de forte potencial é transferido para um ADP, formando-se 3 – fosfoglicerato.
Isomerisação em 2-fosfoglicerato
Esta reacção é catalisada pela fosfogliceromutase
Formação do acido fosfoenolpiruvico
A enolase catalisa a formação de um enol e de um fosfato de forte potencial
Formação do acido piruvico
Forma-se por desfosforilação pela acção da piruvato cinase com formação de um ATP
Regulação da glicolise
Fosfofructocinase
É o enzima regulador primário da glicolise
É inibida alostericamente pelo ATP que diminui a sua afinidade para o substracto
O citrato é um inibidor porque impede a ligação do ATP ao sitio alosterico
Quando o estado energético da célula é baixo (AMP e ADP baixos), o ATP é deslocado do sitio alosterico pelo AMP
Fructose-2,6 – bisfosfato
É o efector alosterico mais potente da fosfofrutocinase
A sua síntese é catalisada por um enzima bifuncional, a fosfofrutocinase 2, que actua como fosfatase quando fosforilada e como cinase como desfosforilada
A fosforilação é activada pelo AMP cíclico. Por esta razão os estimuladores do AMP cíclico ( adrenalina, glucagina) inibem a glicolise e os inibidores(insulina) estimulam
Hexocinase
As hexoquinases I,II e III, mas não as IV são reguladas indirectamente pela fosfofrutocinase 1.
Se este enzima é inibido acumula-se frutose-6-fosfato que pela lei da acção das massas forçará a reacção reversível da fosfoglicoisomerase, originando a glicose-6-fosfato que é um inibidor das hexocinases
Piruvato-cinase
Tem quatro subunidades
Tem três isoenzimas : M existente no musculo, L no fígado e A nos outros tecidos
Pode haver duas formas de regulação: alosterica e fosforilação
Regulação alosterica
O substrato liga-se às quatro subunidades do enzima de um modo cooperativo, de um modo semelhante à ligação do oxigénio com a hemoglobina
Todos os isoenzimas são inibidos pelo acetil-CoA
A fructose-1,6 – bisfosfato é um activador
O ATP e a alanina são inibidores alostéricos
Regulação por fosforilação
Só se passa no isoenzima L
A fosforilação estimulada pelo AMP cíclico inibe o isoenzima
A inibição produzida pelo AMP cíclica, produzida por exemplo pela glucagina, faz dirigir o fosfoenolpiruvato para a neoglicogenese
Balanço energético
O numero de ATP formados em anaerobiose é reduzido , em oposição aos formados em aerobiose
Ciclo de Rapaport-Luebring
No eritrocito encontra-se o ácido 2,3 – bisfosfoglicerico
As suas cargas negativas unem-se às cadeias de carga positiva da hemoglobina facilitando a expulsão de oxigénio para os tecidos
Forma-se a partir do acido 1,3-bisfosfoglicerico pelo ciclo de Rapaport-Luebring
Aumenta em populações vivendo em altas altitudes devido à falta de oxigénio, em situações de anoxia,e em doenças crónicas em que haja má distribuição de oxigénio e em anemias graves
CAPITULO 4
DESTINOS DO ACIDO PIRUVICO
Aerobiose
Mecanismos
O acido piruvico é descarboxilado em acetil-CoA
Esta descarboxilação tem um mecanismo semelhante à do acido a-cetoglutarico no ciclo de Krebs
São cofactores o pirofosfato de tiamina(PTT), coenzima A e acido lipoico
O complexo multienzimatico tem três enzimas – piruvato deidrogenase( PDH), dihidrolipoil transacetilase e piruvato deid
Regulação
A piruvato deidrogenase existe sob uma forma activa, desfosforilada, e inactiva fosforilada
A fosforilação e desfosforilação dependem da PDH cinase e da PDH fosfatase, respectivamente
Estes enzimas dependem do AMP cíclico
Quando o nível energetico da célula é alto( aumento de ATP,NADH e acetil CoA)a cinase é activada
0
Anaerobiose
Revisões de conjunto
Fermentação láctica
No decorrer de esforços musculares intensos, não há um aporte de oxigénio suficiente para regenerar o NADH
Nesta situação, os hidrogénios são cedidos ao acido piruvico para formar o acido láctico
Nos tecidos sem mitocondrias, como os eritrocitos, o metabolismo do piruvato é sempre anaeróbico.
A acção da láctico deidrogenase é reversível e assim o acido láctico captado por outros tecidos pode ser convertido em piruvico. É .o que se passa no musculo cardíaco e alguns músculos esqueleticos
Fermentação alcoólica
Nas leveduras não há piruvico deidrogenase.
O enzima que actuará sobre o acido piruvico é a piruvico-descarboxilase que descarboxila o acido piruvico em acetaldeido
O NADH não regenerado pelo oxigénio, é transferido para o acetaldeido, formando-se álcool etílico.
O enzima é a álcool deidrogenase
Neoglicogenese
.
Destinos do acido piruvico
Capitulo 5
PRODUÇÃO DE ENERGIA NO MUSCULO
Hidrolise do ATP
A forma mais fácil e eficaz de o musculo obter energia é a hidrolise do ATP
Resintese do ATP
Quando no decorrer de um esforço muscular prolongado, o ATP terá que ser resintetizado, pois é a única forma de energia utilizada pelo musculo.
Nestas situações, o musculo recorre a uma reserva energética, a fosfocreatina, que tem um fosfato de alto potencial
A creatinafosfocinase hidrolisa a fosfocreatina, libertando o fosfato de alto potencial que irá resintetizar o ATP
Resintese do ATP e da fosfocreatina
Findo o esforço, é necessário refazer as reservas energéticas
É necessário recorrer à glicolise e à fase aeróbia para formar ATP
Como a glicose foi toda gasta, é necessário recorrer
à glicogenolise para obter nova glicose.
Os primeiros ATP formados serão utilizados para regenerar a fosfocreationa
Capitulo 6
PATOLOGIA DA GLICOLISE
Revisões de conjunto
Piruvato cinase
Os eritrocitos maduros dependem totalmente da glicolise para formar ATP pois não tendo mitocondrias não há vias aerobicas
Na ausência hereditária de piruvato cinase não se forma ATP
As bombas iónicas ATP dependentes não funcionam
Os eritrocitos deixam de ter uma forma bicôncava que lhes permitia escorregar através dos capilares para fornecer oxigénio aos tecidos
Os eritrocitos tumefazem-se e lisam deixando sair a hemoglobina, havendo uma anemia que por haver hemolise se chama hemolitica
Hiperlactacidemia
A hiperlactacidemia do recemnascido e da criança jovem resulta da falta de oxidação do NADH que acarreta haver menos NAD para transportar hidrogénio
Parte do hidrogénio não transportado combina-se com o acido piruvico para dar acido láctico
Outras causas possíveis são a falta dos enzimas da neoglicogenese ou dos enzimas que metabolizam o acido pirúvico
Capitulo 7
GLICOGENESE
Dà-se o nome de glicogénese à formação do glicogénio a partir da glicose.
É um processo que ocorre pràticamente em todos os órgãos e tecidos, mas principalmente no fígado e músculo
Revisões de conjunto
Principais etapas
Formação de UDP-glicose
Fosforilação da glicose em glicose-6-fosfato pela acção de uma hexocinase.
Isomerização desta em glicose-1- fosfato pela fosfoglicomutase na presença da glicose-1,6-bisfosfato.
A glicose-1- fosfato combina-se com a UDP para dar UDPGlicose (UDPG) pela acção da UDPG pirofosforilase
Este enzima é inibido competitivamente pela galactose-1-fosfato, facto que é responsável pela toxicidade da galactose-1-.fosfato que se acumula na galactosemia
Formação de cadeias lineares
A formação das cadeias lineares faz-se pela acção da glicogénio-sintase na presença de uma matriz de glicogénio.
Este enzima transfere um C1 da glicose UDPG para o C4 de uma glicose terminal, com libertação de UDP produzindo o alargamento das cadeias 1-4
Este alongamento das cadeias necessita de uma proteina incluida na molécula do glicogénio, a glicogenina que tem a propriedade de catalisar a sua própria glicosilação ligando o C1 duma UDPG a um resíduo tirosina.
Formas da glicogénio sintase
Existe sob duas formas – forma a activa, não fosforilada e forma b, inactiva, fosforilada
Forma a
A forma a é fosforilada por uma cinase
A cinase tem uma forma inactiva (I ) e uma forma activa (A) .
A forma I é activada pelo AMP cíclico formado a partir do ATP por um sistema em cascata activado pela adrenalina
No músculo existe uma outra cinase dependente do cálcio e fosfolípidos, activada pelo diacilglicerol. É a proteina cinase C.
No musculo pode ser activada por um factor proteico, na presença de calcio
Existe uma cinase activada pelo sistema cálcio- calmodulina
Forma b
A forma b é desfosforilada por uma proteina fosfatase I inibida pelo glicogénio e activada pela insulina e corticosteroides
Regulação das fosforilases
O AMP libertado pela destruição do ATP durante a contracção muscular activa alostericamente a fosforilase b
Os impulsos nervosos libertam cálcio do retículo sarcoplasmico
O cálcio liga-se à calmodulina, modificador da cinase
A fosforilato cinase também é activada pela fosforilação da proteína cinase A, permitindo a ligação da adrenalina aos receptores da membrana
Introdução de ramificações
A glicogénio sintase forma apenas cadeias lineares ( ligações 1-4 ).
A formação de ramificações (ligações 1,4-1,6) necessita do enzima ramificante ou amilo(1,4-1,6) transglicosidase.
Este enzima transfere um mínimo de seis glicosilos para um oxidrilo em C6, estabelecendo um ponto de ramificação
A ramificação cresce em seguida por acréscimo de ligações 1-4 até se fazer outra ramificação
Capitulo 9
GLICOGENOLISE
É o processo pelo qual o glicogénio é degradado em glicose
A glicose formada ou é degradada para formar ATP ou entra na circulaçãoPode fazer-se no citoplasma ou nos lisossomas
Glicogenólise no citoplasma
Degradação das cadeias lineares
A degradação das cadeias lineares faz-se pela acção de transglicosidases geralmente conhecidas por fosforilases.
Estes enzimas cindem o ortofosfato, fixando-se o fosfato na molécula de glicose que se irá cindir e o OH na molécula distal, formando-se glicose-1-fosfato e uma molécula de glicogénio com menos uma glicose
Acção sobre as ramificações
.
A reacção vai continuando até surgir a primeira ramificação 1~6 onde irá actuar o enzima desramificante ou amilo-1,6-glicosidase
Fosforilase muscular
Estrutura
A fosforilase a é constituida por quatro subunidades contendo cada uma uma molécula de fosfato de piridoxal e uma de fosfoserina.
A fosfatase b é dimerica
Conversão da a em b
A forma a converte-se na b pela desfosforilação das quatro fosfoserinas pela acção da fosfatase da fosforilase, separando-se em dois dímeros
É activada pelo AMP e inibida pela glicose-6-fosfato e pelo ATP
Conversão da b em a
A forma b converte-se em a pela acção da fosforilase cinase na presença de ATP e magnésio.
Esta cinase é a mesma que intervem na glicogénese, e tem o mesmo sistema de activação
Fosforilase hepática
As fosforilases hepáticas são diméricas diferindo apenas na existência de serina ou de fosfoserina.
O sistema é activado pela adenilciclase mas não pelo cálcio.
Formação da glicose-6- fosfato
Na glicogenolise forma-se glicose-1- fosfato
Como a forma activa da glicose é a glicose-6-fosfato, esta terá que se converter pela acção da fosfoglicomutase
Transformação da glicose-6-fosfato em glicose
É uma hidrólise catalisada pela glicose-6- fosfatase
Passa-se no fígado, rim e intestino, mas não no musculo
O enzima é reprimido pela insulina e induzido pelos glicocorticoides
Glicogenólise nos lisossomas
Nos lisossomas a cisão do glicogénio faz-se por hidrólise e não por fosforólise., pela acção de uma maltase acida
Passa-se no fígado, rim e intestino, mas não no musculo
O enzima é reprimido pela insulina e induzido pelos glicocorticoides
Capitulo 10
Glicogenoses
Devem-se à falta de um enzima do metabolismo do glicogénio
Number
|
Enzyme deficiency
|
Eponym
|
Symptoms[2]
|
| |||
| |||
| |||
| |||
| |||
| |||
| |||
GSD type VIII
|
(In the past, considered a distinct condition.[3] Now classified with VI.[4] Has been described as X-linked recessive.[5])
| ||
-
|
| ||
GSD type X
| |||
-
|
|
Glicogenose tipo 0
Falta a glicogénio sintase
Como não se forma glicogénio, não haverá glicogenolise e por esta razão os doentes não mantêm a glicose em jejum.
Estão indicadas refeições frequentes ricas em proteínas e à noite suplementos de anido de milho cru
Glicogenose tipo Ia ou doença de von Gierke
Deve-se à falta de glicose 6 fosfatase
A glicose-6-fosfato acumulada inibe a fosforilase e activa a sintase
O glicogénio acumula-se no fígado e no rim provocando hepatomegalia e insuficiência renal.
Os sintomas surgem nos primeiros anos de vida com hepatomegalia, hipoglicemia e acidose láctica
O tratamento visa essencialmente a manutenção da glicemia pela infusão nasogastrica de glicose ou administração oral de milho cru
Revisões de conjunto
Glicogenose tipo II ou doença de Pompe
Falta a maltase acida
Acumula-se glicogénio nos lisosomas
Há hipoglicemia devido à cisão deficiente do glicogénio
Afecta gravemente os músculos
Glicogenose tipo III, doença de Forbes ou doença dos Cori
Falta o enzima desramificante, formando-se um glicogénio anormal com muitas cadeias 1-6
Pode observar-se uma miopatia progressiva
Glicogenose tipo IV ou doença de Andersen
Falta o enzima desramificante
Acumula-se um glicogénio com poucas ramificações
O glicogénio pode comportar-se no fígado como um corpo estranho, desencadeando uma reacção auto-imune
Leva a uma cirrose progressiva, insuficiência hepática e morte
Há uma forma neuromuscular
Glicogenose tipo V ou doença de Mc Ardle
Falta a fosforilase muscular
Diminui a glicogenolise, acarretando menor produção de ATP que se reflectirá no exercício físico
Glicogenose tipo VI ou doença de Hers
Falta a fosforilase hepática
Os principais sinais são hepatomegalia, hipoglicemia ligeira e acidose
Melhora com a idade
Glicogenose tipo VII ou doença de Tarui
Falta a fosfofrutocinase
A glicose-6-fosfato acumulada estimula a síntese da UDP-glicose fosforilase, acumulando-se glicogénio no musculo
Glicogenose tipo VIII
Falta a cinase da fosforilase
Acumula-se glicogénio normal
Capitulo 11
NEOGLICOGENESE
Na ausência de glicose, a manutenção da glicémia faz-se a partir de precursores não glucídicos.
Este mecanismo de homeostase é indispensável pois o sistema nervoso central dos mamíferos utiliza apenas a glicose como fonte de energia.
Define-se neoglicogénese como a formação de glicose a partir de material não glucídico e do lactato.
Todos os precursores vão ser encaminhados para uma via comum a partir do piruvato ou do lactato para onde convergem vias especiais indo dos precursores ao piruvato0
Denominam-se sítios de neoglicogénese aos orgãos onde se realiza a via final. São eles o fígado e o rim e em menor extensão as células epiteliais do intestino delgado.
A capacidade neoglicogenica destes órgãos contrasta com a sua fraca capacidade glicolítica
O consumo energético da neoglicogénese é elevado – a conversão de dois moles de piruvato em glicose exige 4 ATP, 2 GTP e 2 NADH.
Vias especiais
Amino-ácidos
Faz-se a partir dos aminoácidos glicoformadores que por desaminação ou transaminação originam ácido pirúvico, a-cetoglutárico, oxaloacético ou acetil-coenzima A
Estes aminoácidos são:
Originando alfa-cetoglutarico
- Acido glutamico
- Histidina
- Hidroxiprolina
- Arginina
Originando acido oxaloacetico
- Acido aspártico
Originando acido piruvico
- Alanina
- Serina
- Glicocola(via serina)
- Treonina (via glicocola)
- Serina
- Cisteina
Originando succinil-CoA(via propionil-CoA)
- Treonina
- Valina
- Isoleucina
Lípidos
Acidos gordos com um numero par de carbonos
Por beta-oxidação formam acetil-CoA
Alem disso altos níveis de acetil CoA activam a piruvico carboxilase e inibem a piruvico deidrogenase
Ácidos gordos com um numero impar de carbonos
Formam propionil-CoA que por sua vez origina o succinil-CoA
Via final
A neoglicogénese não é o inverso da glicólise porque nem todas as reacções reversíveis devido a barreiras energéticas.
Os enzimas que funcionam numa só direcção são os enzimas chave( glicolíticos ou glicogénicos).
Os enzimas que funcionam nas duas direcções são os enzimas bifuncionais.
Enzimas glicoliticos chave
Barreiras energéticas impedem que algumas reacções sejam reversíveis .São as reacções catalisadas por
- Hexocinases
- Fosfofrutocinase 1
- Piruvato cinase
Enzimas glicogenico chave
São enzimas que catalisam as reacções inversas dos enzimas glicogenicos chave:
¨ Formação do ácido enolpirúvico
¨ Desforilação da fructose –1,6- bisfosfato em frutose-6-fosfato
¨ Passagem de glicose-6- fosfato a glicose
Formação do ácido fosfoenolpirúvico
Esta reacção faz-se em duas étapas:
¨ Formação do ácido oxaloacético
¨ Descarboxilação fosforilante deste em ácido fosfoenolpirúvico
Formação de ácido oxaloacético
Trata-se da reacção de Wood e Werkman, catalisada pela piruvato carboxilase.
Necessita de ATP.
Tem a biotina como coenzima.
A fixação da biotina ao enzima é activada pelo acetil-CoA
CO2
ATP
Acido pirúvico --------------- Acido oxaloacetico
Piruvico carboxilase
Descarboxilação fosforilante do ácido oxaloacético
O fosfato de alto potencial necessário para esta reacção vem do GTP
.O enzima que catalisa esta reacção é a fosfoenolpiruvato carboxicinase
cortesia de Joyce Diwan
Travessia das mitocôndrias
O ácido oxaloacético forma-se nas mitocôndrias mas a sua transformação em fosfoenolpirúvico é extramitocondrial.
Como o oxaloacético não atravessa a membrana mitocondrial, terá que se transformar num composto que atravesse a membrana e em seguida se reconverta nele.
Há duas vias – a via do malato e a via do aspartato.
Via do malato
O oxaloacetato é reduzido em malato pela malatodeidrogenase mitocondrial na presença de NADH.
A translocase dos ácidos dicarboxílicos faz o malato abandonar as mitocôndrias para este no citoplasma dar de novo oxaloacetato.
Via do aspartato
A aspartatoaminotransferase transamina o oxaloacético em ácido aspártico.
Uma translocase transfere o ácio aspártico para o citoplasma onde se converte de novo em oxaloacético
Desfosforilação da frutose-1,6-bisfosfato
A frutose-1,6-bisfosfatase catalisa esta reacção.
O ADP é um efector alostérico negativo ao mesmo tempo que activa a fosfofrutocinase.
O enzima é activado pelo ácido láctico e pelo cortisol.
Desfosforilação da glicose-6-fosfato
A hidrólise irreversível do fosfato é catalisada pela glicose-6-fosfatase.
O enzima está fortemente ligado à membrana
A glicose-6-fosfato é transportada para o retículo por um transportador, sendo aí hidrolisada
A glicose formada é transportada de novo para o citossol por um transportador
Necessita de fosfolípidos para a sua actividade.
É inibido pelos fosfatos e pela glicose
Necessita de três transportadores
1. Transporte d a glicose-6-fosfato para o lume
2. Transporte do fosfato para o citossol
3. Transporte da glicose para o citossol
Ciclo dos Cori
O músculo não consegue transformar em piruvato o ácido láctico formado após um esforço muscular intenso.
Para se converter em piruvato, o ácido láctico tem que ser transportado para o fígado ou rim, que têm enzimas que permitem fazer esta conversão- é o ciclo dos Cori
Ciclo de Fehlig
Uma outra forma de metabolização do acido piruvico pelo musculo para fins glicogenicos é a sai conversão em alanina
A alanina dirigir-se-á para o fígado, onde será reconvertida em acido piruvico
É o ciclo de Fehlig
Regulação
A glicolise e a neoglicogenese são controladas pelos mesmos mecanismos, para que funcione apenas uma das vias
A fosfofrutocinase 1 é estimulada pelo AMP e inibida pelo ATP e citratos, efectores que têm uma acção oposta sobre a frutose-1,6-bisfosfatase
Assim, quando há um baixo nível energético, a glicolise é estimulada e no caso contrario é estimulada a gliconeogenese
A frutose-1,6- bisfosfato tem níveis baixos na inanição e elevados na saciedade
O antagonismo glucagina-insulina implica a estimulação da gliconeogenese na inanição e da glicolise na saciedade
A piruvatocinase é inibida pela ATP e Alina, ao contrario da carboxicinase
Capitulo 12
REGULAÇÃO DO METABOLISMO DO GLICOGENIO
A regulação do metabolismo do glicogénio faz-se através de dois enzimas fundamentais, a glicogénio sintase e a fosforilase.
O AMP cíclico desempenha um papel fundamental na regulação destes enzimas pois mediante a fosforilação destes enzimas inibe a sintase e estimula a fosforilase actuando assim no sentido da glicogenólise.
AMP cíclico
O AMP cíclico actua no metabolismo do glicogénio no sentido da glicogenolise pois fosforila a forma a da glicogénio sintetase, tornando-a inactiva e activa a forma a da fosforilase
GLUCAGINA ( fosforilação)
Fosfatase a
Sintase b
GLICOLISE
INSULINA ( desfosforilação)
Fosfatase b
Sintase a
GLICOGENESE
Inibidor proteico I
A glicogenólise é uma forma rápida de mobilização da glicose que só deverá funcionar quando for necessário mobilizà-la ràpidamente.
Esta regulação faz-se pelo balanço fosforilação-desfosforilação, encaminhando a fosforilação para a glicogenólise e a desfosforilação para a glicogénese.
A desfosforilação é assegurada pela fosfoproteina fosfatase I que desfosforila a glicogénio sintase, a fosforilase e a cinase.
Este enzima é inibido pelo inibidor proteico I que se forma por fosforilação da sua forma inactiva pela acção da proteina cinase formada pelo AMP cíclico.
O inibidor é inactivado ao ser desfosforilado por uma fosfoproteina fosfatase I.
RESUMINDO: Ao ser activado o inibidor proteico I activa todos os enzimas que levam à glicogenólise passando-se o contrário quando é desfosforilado.
Capitulo 13
PATOLOGIA DA NEOGLICOGENESE
Deficiência em Glicose-6-fosfatase
É a glicogenose tipo I
Deficiência em frutose-1,6-bisfosfatase
Sintomas
Hiperventilação
Convulsões
Coma
Tratamento
Tratamento das crises agudas pela infusão intravenosa de glicose
Evitar jejum
Restrição de frutose e sacarose
Para prevenção da hipoglicemia dar um glucido de libertação lenta como o amido de milho
Deficiência em piruvico carboxilase
Consequência da deficiencia
Deplecção de oxaloacetato acarretando níveis reduzidos de aspartato, metabolito necessário para a síntese da ureia
Sintomas
Acidose láctica
Hiperamoniemia
Tratamento
Suplementos de aspartato e citrato
Capitulo 14
Regulação da glicemia
O fígado dos mamíferos é capaz de responder a níveis diferentes de glicose circulante. Quando o teor em glicose do sangue portal é alto, o fígado absorve mais glicose. Quando é baixo, liberta glicose.
Como as células hepaticas são totalmente permeáveis à glicose, pensa-se que o balanço entre a absorção e a libertação de glicose se deve à actividade dos enzimas glicoliticos e glicogenicos chave.
Na regulação da glicemia as hormonas desempenham um papel importante.
AMP cíclico
Muitas hormonas actuam sobre o AMP cíclico
Insulina
A insulina inibe a formação do AMP cíclico
Combina-se com um receptor que induz a síntese de um segundo mensageiro que inactiva a cinase
Induz os enzimas glicolitico chave inibe os glicogenico chave
Induz os enzimas da lipogenese e inibe os lipoliticos ( acção sobre o AMP cíclico)
Alem disso facilita a entrada da glicose na celula
Favorece a glicogenese
Adrenalina
A adrenalina estimula a produção de AMP cíclico combinando-se com uma proteina específica existente no interior da membrana, o receptor adrenérgico.
O complexo receptor- adrenalina na presença de ATP combina-se com a proteina G estimulando a adenilciclase.
A adrenalina actua apenas no músculo e não no fígado
Glucagina
No fígado a glucagina toma o lugar da adrenalina.
Como resposta a uma descida da glicose sanguínea as células do pâncreas segregam glucagina que combinando-se a um receptor estimula a adenilciclase por um mecanismo semelhantre ao da adrenalina, favorecendo assim a glicogenólise
Na figura seguinte estão esquematizadas as acções da insulina e glucagina na regulação da glicemia
Glicocorticoides
- Activam o catabolismo das proteínas e lipidos, favorecendo a neoglicogenese
- O acetil CoA formadono catabolismo dos lipidos activa a piruvato carboxilase, enzima glicogenico chave, e inibe os glicoliticos chave
- Induzem a síntese dos enzimas glicogenico chave
Capitulo 15
DIABETES
Conceitos
A diabetes mellitus é uma doença heterogenica caracterizada pela presença de hiperglicemia
A hiperglicemia é devida a uma deficiência da acção da insulina
As duas principais causas são a menor produção de insulina pelo pâncreas ou uma resposta deficiente da insulina nos órgãos alvo
Estas duas causas definem dois tipos de diabetes – tipo 1 e tipo 2 respectivamente
Diabetes tipo 1
Causas
É causada pela destruição autoimune das células beta dos ilhéus de Langerhans
A reacção inicia-se por um mecanismo desconhecido
A destruição das células beta desencadeia uma menor produção de insulina com hiperglicemia e os outros sinais de diabetes
Parece ser o resultado da combinação de uma susceptibilidade genetica com factores ambientais
Fases
Existência de autoanticorpos com glicose pós-prandial normal
Diminuição da tolerância à glicose
Hiperglicemia em jejum embora se produza ainda insulina suficiente para produzir a cetose
A produção de insulina desce ainda mais e os doentes tornam-se dependentes da insulina exógena
Complicações
São a aterosclerose, neuropatia periférica, insuficiência renal, retinopatia
O desenvolvimento e gravidade destas complicações dependem do substracto genético e do grau de controle metabólico
Um controle rigoroso da glicemia reduz o risco das complicações de 35 a 75%
Diabetes tipo 2
Causas
Surge no adulto, quase sempres após a meia idade
Não é autoimune
A susceptibilidade genética é um requisito indispensável mas a sua expressão clínica está determinada em parte por factores ambientais
Nos tipo 2 a resposta à ingestão de glicose é inadequada e os padrões basais são elevados, sinais de resistência à insulina
Complicações
As mesmas do tipo 1
Tratamento
A perda de peso, o aumento do exercício físico e a supressão do açucar são os métodos mais efectivos
Quando não resultam totalmente devem ser complementados com hipoglicemiantes orais como as sulfanilureias ou as biguanidas
Capitulo 16
Capitulo 17
CICLO DE DICKENS-HORECKER
Conceito
Via que utiliza os seis carbonos da glicose para gerar equivalentes redutores e pentoses
Também é conhecido por ciclo das pentoses, via das pentose-fosfatos e desvio das hexose-fosfatos
Realiza-se no figado, tecido adiposo, córtex suprarenal, testículos, glândula mamaria lactante e eritrocitos
Tem uma fase oxidativa e uma não oxidativa
Via oxidativa
Formação de fosfoglicolactona
O C1 da glicose-6-fosfato perde dois hidrogénios, captados pelo NADP
A reacção é catalisada pela glicose-6-fosfato deidrogenase ou enzima intermediário de Warburg
É inibido por certas drogas como as sulfonamidas e a primaquina e activada pela insulina
Mais de 100.000 pessoas têm uma deficiência hereditária neste enzima
Formação de acido fosfogluconico
A lactonase transforma a fosfoglicolactona em acido fosfogluconico
Formação de ribulose-5-fosfato
Forma-se uma cetona intermediaria, sendo os hidrogenios captados pelo NADP
O NADPH formado é utilizado no metabolismo dos lípidos
Isomerização das pentoses-fosfato
A fosfopentose-epimerase transforma a ribulose-5-fosfato em xilulose-5-fosfato e a fosfopentose isomerase isomeiza-a em ribose-5- fosfato
Há uma série de transferências de dois e três carbonos com formação de trioses e hexoses
1ª transcetolização
Transfere o C1 e C2 (cetol) da xilulose-5- fosfato para a ribose-5-fosfato originando uma cetose, a sedoheptulose-7-fosfato e o gliceraldeido-3-fosfato
A reacção é catalisada pela transcetolase
Dois compostos com cinco carbonos, originaram um com 7 e um com 3
Aldolização
A aldolase catalisa a transferência de três carbonos da sedoheptulose-7-fosfato para o fosfogliceraldeido para originar um composto com quatro carbonos (eritrose-4-fosfato) e um com seis (frutose-6-fosfato)
2ª transcetolização
A transcetolase efectua uma nova recombinação os dois primeiros carbonos da xilulose para a eritrose
Equilentes redutores sob a forma de NADPH que serão utilizados em reacções de síntese
Fornecer ribose para a síntese dos ácidos nucleicos
Manter a integridade da membrana dos eritrocitos pela redução do glutatião
Metabolisar as pentoses alimentares
Regulação
O factor mais importante é a concentração celular de NADPH
A disponibilidade em NADP regula a reacção limitante, a reacção da glicose-6-fosfato-deidrogenase
Capitulo 18
PATOLOGIA DO CICLO DE DICKENS-HORECKER
´
Glutatião
O glutatião tem uma actividade anti-oxidante por destruír os peróxidos
A regeneração do glutatião faz-se pela acção da glutatião peroxidase, que necessita de NADPH
Como o ciclo de Dickens.Horecker é o principal fornecedor de NADPH,qualquer falha deste ciclo reflectir-se-á na regeneração do glutatião e consequente aumento do stress oxidativo
Eritrocitos
Nos eritrocitos a única fonte de NADPH é o ciclo de Dickens-Horecker
Qualquer diminuição de produção de NADPH por este ciclo terá sempre consequências nefastas, por falta de alternativas
As consequências serão hemolise por enfraquecimento da parede celular e maior oxidação da hemoglobina em metahemoglobina
Deficiencia em glicose-6-fosfato-deidrogenase
É a deficiência hereditária mais espalhada no mundo – afecta mais de 400 milhões
Na bacia mediterrânica e em Africa está muitas vezes relacionada com a resistência ao Plasmodio falciparum
Nas áreas em que a malária é endémica a deficiência tem uma prevalência de 5 a 25% enquanto que em áreas não endémicas é inferior a 0,5%
A causa dos sintomas é a falta de produção de NADPH
Esta deficiência se manifesta por anemia hemolítica
Manifesta-se na presença de oxidantes
Também tem o nome de favismo por aparecer após a ingestão de favas, que é um oxidante.
Alimentos e medicamentos a evitar
Há alimentos e medicamentos que devem ser completamente proscritos para impedir o aparecimento de uma nova crise
Capitulo 19
METABOLISMO DAS HEXOSES E DA LACTOSE
A quase totalidade do metabolismo das oses e oligosidos faz-se através da glicose
As outras hexoses podem-se converter em glicose ou em intermediários da glicose, do mesmo modo que a glicose pode originar algumas hexoses
Frutose
É fosforilada pela frutocinase em frutose-1-fosfato.
A frutose-1-fosfato é cindida pela aldolase da frutose-1-fosfato em gliceraldeido e fosfodihidroxiacetona
A triose-cinase fosforila o gliceraldeido em fosfogliceraldeido
Galactose
Embora a galactose seja um epimero da glicose, a sua transformação nesta é complexa.
Primeiramente forma-se por accão da galactocinase em galactose-1-fosfato pela acção da galactocinase
Esta transforma-se em UDP galactose pela acção da galactose-1-fosfato uridiltransferase
A epimerização faz-se a este nível pela acção da UDP-galactose-4-epimerase que em seguida irá originar a glicose-1-fosfato
Manose
A hexocinase converte-a em manose-6-fosfato
A manose-6-fosfato-isomerase converte-a em frutose-6-fosfato
Síntese da lactose
É sintetisada pelo sistema lactose-sintetase que contem duas proteínas:
Proteína A
Encontra-se não só na glândula mamaria mas também no fígado e intestino
Forma acetillactosamina pela combinação da UDPGal com a acetilglicosamina
Proteína B
É sintetisada apenas durante a lactação
Modula a proteína A para a formação de lactose
Capitulo 20
PATOLOGIA DO METABOLISMO DAS OSES
Galactose
Existem três formas de galactosemia:
- Falta de Gal-1-fosfato-Uridil transferase
- Falta de galactocinase
- Falta de UDP-gal-4-epimerase
Como as duas primeiras têm os mesmos sintomas serão estudadas em conjunto
Deficiência em transferase
Causas
O recemnascido ingere 20% das suas calorias como lactose, que contem galactose
Na falta deste enzima, a galactose-1-fosfato não se metabolisa, acumulando-se nos rins, fígado e cérebro
A sua transformação em galactitol pode produzir cataratas
Sintomas
Os recemnascidos ou lactentes apresentam entre outros sintomas alterações hepáticas, , convulsões ou letargia, atraso mental e cataratas
Quando o diagnostico não é feito precocemente a cirrose, o atraso mental e as cataratas tornam-se irreversíveis
Cataratas
É um dos sintomas mais frequentes
Deve-se à conversão da galactose no açúcar álcool galacitol por uma galactose redutase dependente do NADPH
Esta redutase só existe no tecido nervoso e no cristalino
A níveis circulantes normais de galactose, a actividade do enzima não causa efeitos lesivos.
A concentrações elevadas o galacitol cria tumefacção osmotica do cristalino com a consequente formação de cataratas
Tratamento
O despiste desta doença permite o tratamento precoce
A eliminação precoce da galactose cura os sintomas
Deficiênia em galactocinase
Os principais metabolitos acvumulados são a galactose e o galactitol
O unico sintoma é representado pelas cataratas
O tratamento é restrição da galactose
Deficiência da UDPGalactose epimerase
Os sintomas são semelhantes aos da deficiência em transferase
Está indicada a restrição da galactose
Frutose
Frutosuria essencial
Falta a fosfofrutocinase hepática
A situação é benigna porque não se acumulam produtos tóxicos
Parte da frutose ingerida é fosforilada parcialmente pela hexocinase, entrando na glicólise
Intolerância hereditária à frutose
Causas
Falta a aldolase
Acumula-se frutose-1-fosfato em vários tecidos, inibindo a glicogeneolise e a gliconeogenese
A frutose necessita de ATP para ser fosforilada.
A acumulação de frutose-1-fosfato leva portanto a uma deplecção de ATP
A falta de ATP impede o fígado de realizar as suas funções normais
principalmente por impedir o funcionamento das bombas dependentes de ATP
Sintomas
Os sintomas só surgem após a administração de frutose ou sacarose
A ingestão aguda de frutose produz hipoglicemia
A ingestão crónica produz atraso de crescimento e insuficiência hepática
Se a ingestão de frutose se mantiver surgem crises hipoglicemicas recidivantes e insuficiências hepática e renal que podem levar à morte
Tratamento
Eliminação total da frutose, sacarose e sorbitol
Capitulo 21
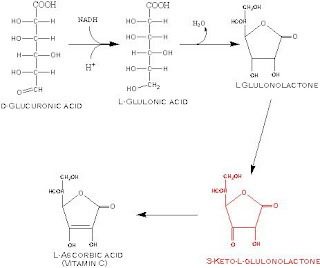
METABOLISMO DOACIDO GLICURONICO
Síntese
A glicose-1-fosfato combina-se com a UTP para dar a UDPG
A UDPG oxida-se no C6 para dar o UDP-glicuronato pela acção da UDPG deidrogenase
Esta, perdendo a UDP origina o acido glicuronico
Catabolismo
Transforma-se em L -xilulose com a formação intermediaria dos ácidos gulonico e cetogulonico
A L-Xilulose isomeriza-se em D-xilulose que entrará no ciclo de Dickens-Horecker
Síntese do acido ascórbico
Os primatas perderam a capacidadede sintetizar o acido ascórbico
Os animais que o sintetizam fazem-no a partir do acido gulonico
PATOLOGIA DOS ACIDOS URONICOS
Pentosuria idiopática
Actividade reduzida da L-xilulose reductase
Grande excreção de pentoses pela urina, especialmente após ingestão de acido glicuronico
É assintomática
Icterícia do recemnascido
O acido glicuronico tem a função de se combinar com substancias endógenas, medicamentos e tóxicos formando glicuronatos
Os glicuronatos são muito hidrosoluveis, facilitando assim a eliminação das substancias com que se conjugaram
Esta capacidade de conjugação nem sempre existe desde o nascimento podendo levar até 2 semanas até se efectuar
Nestes casos não há glicuroconjugação
A situação mais flagrante é a não conjugação com a bilirrubina, surgindo icterícia, a icterícia neonatal
Sindroma de Crigler-Najjar
Deficiência da UDP-glicuronil-transferase
Surge icterícia
Também não há conjugação com outros compostos
Capitulo 22
METABOLISMO DOS DERIVADOS DAS OSES
Desoses
Desoxiribose
Será estudada a propósito do DNA
Fucose
A síntese faz-se a partir da manose-1-fosfato
Intervêm o GTP e o NADPH
Hexosaminas
São sintetizadas a partir da fructose-6-fosfato
Ácidos sialicos
É uma síntese complexa feita a partir da glucosamina-6-fosfato


























































Sem comentários:
Enviar um comentário